El cervell humà es va desenvolupar gràcies als aliments fermentats
19 gener 2024
Click here for the English version: Human brain developed thanks to fermented food
Estic subscrit, entre altres mitjans digitals, a Science Alert, un newsletter —butlletí informatiu— científic gratuït, en el qual cada setmana trobo alguna notícia interessant. Fa poques setmanes em va sorprendre molt especialment una notícia (Dyer R (2023) sobre aquesta hipòtesi del títol, la qual trobo molt versemblant. A banda d’aquesta notícia-resum, per conèixer-ne millor els detalls vaig anar a l’article original de Bryant et al. “Fermentation technology as a driver of human brain expansion”, que us comento a continuació, junt amb altres coses relacionades.
CERVELL MÉS GRAN
La principal característica diferencial dels humans respecte als altres primats i animals en general, és el cervell més gran i complex. Com que quan més gran és un animal, major és el pes de l’encèfal, s’utilitza una mesura relativa que és el quocient d’encefalització (EQ), que és la relació entre la massa de l’encèfal i l’esperada per a un animal típic de les mateixes dimensions. L’EQ de Homo sapiens és al voltant de 7.5, mentre que per a altres primats és entre 2 i 3, i altres mamífers com el gos és entre 1 i 2, excepte els cetacis com orques o dofins, que tenen 3 o 4.
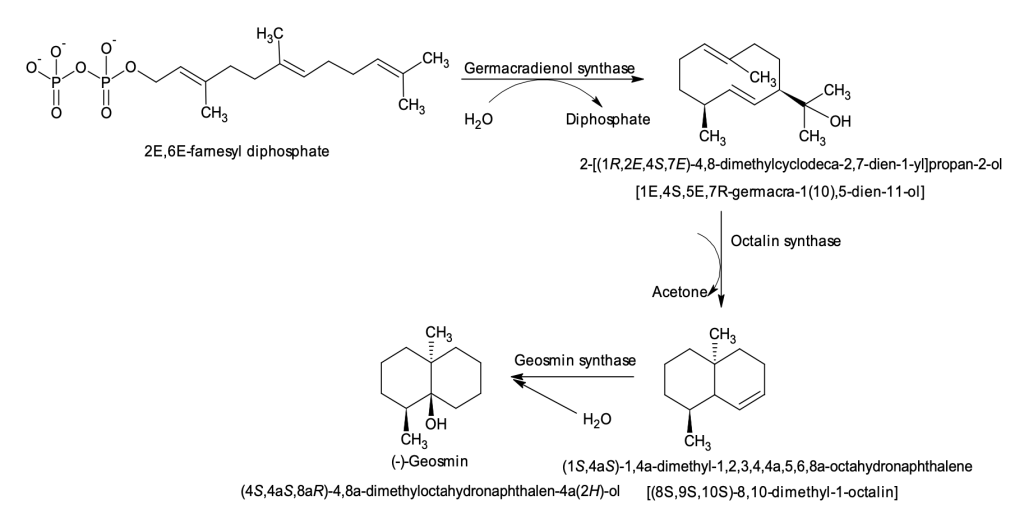
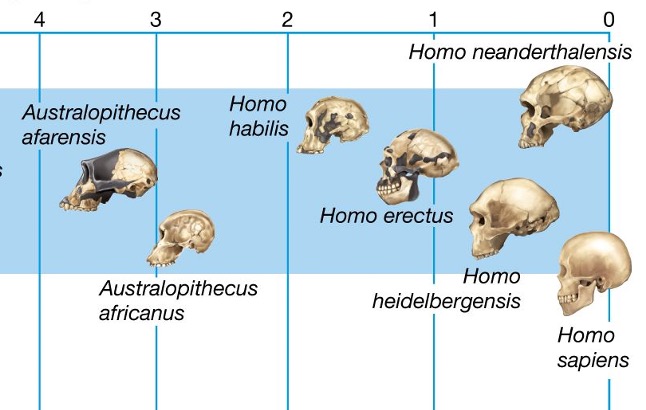
Per tant, el cervell humà va més que triplicar la seva grandària respecte a altres primats en la seva evolució des dels darrers australopitecs —que ja eren bípedes, i per tant tenien les mans lliures— fa uns 2.5 milions d’anys (Ma) fins als primers Homo aproximadament mig milió d’anys després. Els australopitecs tenien un volum endocranial (ECV) de 400 mL (Figura 1), mentre que per a Homo erectus (Figura 2) era d’uns 800 mL, i després l’expansió del cervell va continuar amb l’emergència de H. sapiens i prèviament amb H. neanderthalensis, ambdós amb uns 1500 mL (Miller et al. 2019; Ponce de León et al. 2021). Òbviament aquest engrandiment del cervell i sobretot del còrtex frontal va determinar l’augment de les capacitats de raonament, reflexió, adaptació, socialització i d’altres habilitats, o sigui del desenvolupament de la intel·ligència humana.

MÉS CERVELL i MENYS BUDELLS
Hi ha diverses teories sobre els mecanismes que haurien afavorit aquesta accelerada expansió del cervell. El factor limitant en l’engrandiment és la disponibilitat de recursos calòrics, perquè el cervell té una alta despesa metabòlica, comparada amb la majoria d’altres teixits. La taxa metabòlica en repòs del cervell suposa el 22% de la del cos humà (McClave & Snider 2001).
Les mutacions que van portar a un augment de mida del cervell, encara que tindrien uns clars beneficis finals, no serien adaptatives si comportaven un major risc de fam. Una reducció en la quantitat de teixit intestinal, que té unes necessitats metabòliques similars a les del cervell, alliberaria calories necessàries per a la digestió per tal de reassignar-les al cervell. Això es confirma pel fet que la mida del còlon dels humans és la quarta part del corresponent a primats de la nostra talla (Taula 1), mentre que el cervell dels H. sapiens actuals és quasi el triple del que correspondria.
Taula 1. Masses esperades d’alguns òrgans humans basades en els valors dels grans simis en comparació amb les reals d’un humà occidental actual de 65 kg (Adaptat de Bryant et al 2023).
| Òrgan | Massa esperada (kg) | Massa real (kg) | Real / esperada |
| Cor | 0.32 | 0.30 | 0.94 |
| Fetge | 0.24 | 0.30 | 1.25 |
| Budell prim | 0.40 | 0.62 | 1.55 |
| Còlon | 0.85 | 0.22 | 0.26 |
| Cervell | 0.45 | 1.30 | 2.89 |
CANVIS DE DIETA
Tanmateix, la reducció intestinal havia d’anar acompanyada d’un canvi a la dieta, amb aliments més fàcils de digerir i més energètics. Els homínids precursors d’Homo haurien passat d’un règim herbívor-frugívor a un omnívor-carnívor. Les hipòtesis actuals apunten als dos canvis següents, força coneguts i bastant versemblants:
1) El major consum de carn —de proteïna animal en general— s’ha argumentat com un dels elements clau en l’evolució humana. La dieta de H. sapiens és clarament més carnívora que els altres primats parents, i per tant la cacera d’altres animals hauria d’haver estat un hàbit creixent als precursors de Homo (Mann 2000). Tanmateix, un punt feble d’aquesta hipòtesi és que sembla que la caça era poc important inicialment, fa 1-2 Ma, ja que aquests primers Homo i els seus precursors eren sobretot recol·lectors, i la cacera es desenvolupà plenament força després, a finals del paleolític inferior —com a molt fa uns 500.000 anys—, en paral·lel al desenvolupament de les primeres armes prehistòriques (Bryant et al. 2023).
En canvi, sembla que el consum de carronya deixada per altres animals carnívors fou anterior a la cacera, des del final del pliocè o inicis del plistocè fa uns 3 Ma. Una alternativa relacionada amb la necrofàgia però més profitosa per consumir carn és prendre les preses caçades per altres animals. De fet, els registres arqueològics demostren que aquesta darrera opció per obtenir carn fresca era predominant sobre la de ser carronyaires passius, on el rendiment de consum càrnic és més baix (Bunn & Ezzo 1993).
Però el consum de proteïna animal d’alt valor nutritiu no es limita a la carn de mamífers i aus: cal tenir en compte la pesca i sobretot la recol·lecció de marisc. Aquest darrer cas té l’avantatge arqueològic d’haver-se trobat molts llocs amb closquers —acumulació de closques de mol·luscs— que indiquen la gran explotació d’aquest recurs proteic que els humans han fet de fa temps. Els closquers trobats més antics són els de Pinnacle Point a Sudàfrica fa 160.000 anys, molt importants perquè junt amb altres restes són una de les evidències dels primers Homo sapiens (Marean et al. 2007), però és clar, són certament posteriors al desenvolupament del cervell.
2) La domesticació del foc i la conseqüent possibilitat de cuinar els aliments va ser un altre element crucial per obtenir més substrats calòrics biodisponibles i digerir-los més fàcilment, tant a nivell de masticació mecànica com de despesa energètica necessària al tracte digestiu. Això és molt evident en el consum de carn comentat, tant fresca com de carronya, i a més en aquest cas per mitigar la contaminació microbiana. A més a més el cuinat també va ser molt important en permetre la ingestió d’aliments vegetals i sobretot dels tubercles, òrgans de reserva soterranis molt rics en carbohidrats, però que no són directament digeribles i/o contenen compostos tòxics si no es couen (Wrangham et al. 1999).
Tanmateix, no hi ha evidències arqueològiques clares de què els australopitecs o els primers Homo dominessin el foc, i les primeres evidències serien per als H. erectus entre 1 i 1.5 Ma (Hlubik et al. 2019) però més clarament de fa 800.000 anys (Goren-Inbar et al 2004). Per tant, el ple domini del foc hauria estat posterior a l’inici del desenvolupament del cervell. De fet, l’expertesa del foc requereix la capacitat cognitiva de planejar, crear, mantenir i usar el foc efectivament, o sigui, un cervell més desenvolupat que el dels australopitecs (Bryant et al. 2023).
HIPÒTESI DE LA FERMENTACIÓ EXTERNA dels aliments, en contrast amb l’habitual “INTERNA”
Els autors del treball (Bryant et al. 2023) proposen aquest terme d’externa per diferenciar-lo de la fermentació interna que és la realitzada per la microbiota del tracte gastrointestinal humà en la digestió. La idea és que l’externalització d’aquesta fermentació interna va alliberar requeriments energètics corporals que van permetre l’expansió cerebral.
Cal recordar que aquí s’utilitza el terme “fermentació” en la seva accepció més general de transformació de compostos orgànics per part de microorganismes, mentre que l’accepció original del concepte “fermentació” en sentit bioquímic estrictament és el tipus de metabolisme heteròtrof anaeròbic on font d’energia i carboni són compostos orgànics i l’acceptor d’electrons són aquests mateixos compostos. La majoria de fermentacions d’aliments com la làctica o alcohòlica són d’aquesta accepció bioquímicament parlant, però altres processos de transformació microbiana que incloem a més d’aquestes quan es parla de “fermentació” en general, són d’altres tipus de metabolisme, com per exemple degradacions aeròbiques o altres reaccions. Podeu veure més informació sobre els aliments fermentats al meu post “Aliments fermentats: consens recent sobre aquest concepte” (Figura 3).

Encara que no és usual anomenar-ho així, la digestió que té lloc al tracte gastrointestinal humà o d’altres animals inclou aquesta “fermentació interna”, entenent com a tal la intervenció microbiana, o sigui el conjunt de transformacions que hi realitzen els microorganismes, la microbiota intestinal, sobretot al còlon. La digestió d’una part important dels components fibrosos vegetals requereix aquesta fermentació interna per part de la microbiota. Als remugants això s’aconsegueix a més amb estómacs addicionals i una microbiota cel·lulolítica abundant. Als altres animals no remugants, inclosos els primats, tenim un còlon i un cec més desenvolupats, i una major àrea per a l’absorció dels nutrients. El còlon dels humans i molts primats conté uns 10^12 microbis per mL i el trànsit per aquest budell gros és d’unes 20-40 hores, mentre que al prim només és 2-4 h. Cada cop és més clara la rellevància de la microbiota del còlon per a la salut, en quant a l’absorció de nutrients, la regulació energètica i un sistema immune correcte (O’Hara & Shanahan 2006).
La fibra soluble, sobretot oligosacàrids, és fermentada per la microbiota produint sobretot àcids grassos de cadena curta (SCFA), que aporten unes 2 cal/g de fibra, que suposa un 50% addicional a les 4 cal/g disponibles per la digestió directa dels carbohidrats fàcils (midó, sucres). Aquestes 2 cal/g són un 2-10% de l’energia total que la dieta ens proporciona, que és molt poca comparada amb altres mamífers (Taula 2). Aquests SCFA són sobretot acetat, propionat i butirat. L’acetat s’utilitza per sintetitzar colesterol i altres SCFA i proporciona energia al cor, ronyons i múscul; el propionat és precursor de la síntesi hepàtica de glucosa i proteïnes; i el butirat és la font d’energia preferida dels colonòcits.
Taula 2. Energia derivada dels àcids grassos de cadena curta (SCFA) produïts per la fermentació de la microbiota intestinal
| Espècie | Dieta | % Energia del total digerit |
| Bou / vaca | Herbívor remugant | 72 |
| Ovella | Herbívor remugant | 84 |
| Conill | Herbívor monogàstric | 32 |
| Castor | Herbívor monogàstric | 19 |
| Porc espí | Herbívor monogàstric | 16 |
| Porc | Omnívor | 36 |
| Aluata, mico udolador | Herbívor monogàstric | 30 |
| Goril·la | Herbívor monogàstric | 57 |
| Homo sapiens | Omnívor | 2-10 |
A banda dels SCFA, els nutrients principals produïts per la microbiota són les vitamines del complex B i la K, que són absorbides per l’intestí. A més, la microbiota augmenta la biodisponibilitat de micronutrients minerals mitjançant la degradació de factors antinutricionals com els fitats i oxalats —presents a molts vegetals— que formen complexos amb els cations (Fe, Zn, Mg, Ca, …) i prevenen la seva absorció.
La fermentació externa dels aliments que van començar a fer els primers humans té unes funcions similars a la interna com l’augment de la biodisponibilitat i absorció de macronutrients i micronutrients. Amb això, s’augmenta la digestibilitat de carbohidrats i proteïnes, per exemple als llegums hidrolitzant les macromolècules a aminoàcids i sucres més digeribles. La fermentació de carbohidrats també fa augmentar les vitamines B disponibles en un ordre de magnitud (Sandhu et al 2017). I els comentats fitats i oxalats poden ser degradats per la fitasa que produeixen bacteris làctics de les fermentacions externes, amb la qual cosa augmenta l’absorció de minerals. Aquesta eliminació del fitat fins i tot és més efectiva fermentant que per cocció, ja que amb aquesta baixa l’activitat de la fitasa per damunt de 80ºC.
Un gran benefici de la fermentació externa és que pot fer que aliments tòxics ho deixin de ser. El cas més conegut és la destoxificació dels glicòsids cianogènics de la mandioca (o iuca o cassava), un aliment bàsic de milions de persones a les zones tropicals. Si no es fermenta, aquests glicòsids són hidrolitzats pels microbis del còlon produint el tòxic cianur. Quan es fermenta adientment els bacteris làctics trenquen les parets cel·lulars dels tubercles i permeten la hidròlisi de la toxina, afavorida també per l’àcid làctic que produeixen (Padmaja & Steinkraus 1995).
A més a més, la fermentació externa dels aliments contribueix a una millor eficàcia de la microbiota intestinal en la digestió. En primer lloc, part de la microbiota ingerida amb l’aliment fermentat pot colonitzar l’intestí, contribuint a la seva biodiversitat, augmentant la capacitat de fermentar més nutrients, i afavorint que alguns microbis endògens produeixin bacteriocines contra possibles patògens. S’ha vist que aquests beneficis també són possibles encara que els microbis de l’aliment fermentat només tinguin un contacte transitori amb els bacteris residents (Ohland & MacNaughton 2010). Amb això, la fermentació externa pot ajudar a la microbiota endògena a protegir l’hoste d’infeccions i malalties, ja que una microbiota correcta produint quantitat de SCFA a partir de la fermentació de carbohidrats no digeribles està ben relacionada amb una reducció dels desordres gastrointestinals (Alexander et al 2019).
FERMENTACIÓ EXTERNA d’ALIMENTS, IMPULSORA DE L’EXPANSIÓ DEL CERVELL HUMÀ
Com hem vist abans, sembla que els canvis de dieta des dels australopitecs als humans, com el major consum de carn o d’aliments cuinats amb el domini del foc, són relativament posteriors a l’expansió del cervell, i només amb aquests canvis no s’acaba d’explicar el ràpid desenvolupament del cervell, simultània a la reducció del còlon i el desplaçament de gran despesa energètica de l’intestí al cervell.
Per als inicis de la fermentació externa d’aliments no caldria tenir una gran capacitat de raonament. Els australopitecs ja tenien algunes eines senzilles que podrien utilitzar per escorxar animals capturats o de la carronya, i podrien transportar aquests aliments fins a l’habitatge, fos cova o balma o refugis temporals, gràcies al bipedisme ja desenvolupat. També podrien transportar fruits, tubercles i altres aliments potencials. Encara que per exemple els ximpanzés ocasionalment poden transportar eines temporals o les restes d’animals caçats, ho fan en distàncies curtes, d’uns centenars de metres com a molt, i la majoria dels aliments els consumeixen al lloc de captura.
Un cop al lloc d’habitatge, aquests primers Homo devien deixar el menjar per anar-lo consumint i acumulant-ne més del capturat. La reutilització de lloc d’emmagatzematge hauria promogut un ecosistema microbià que conduís a la fermentació. Els aliments novament incorporats haurien estat inoculats amb els ja presents al lloc, o al cos dels mateixos homínids, les mans per exemple. Aquesta pràctica transmesa socialment de reutilitzar llocs, contenidors o eines per manipular els aliments hauria anat promovent les fermentacions i l’estabilitat dels agents microbians fermentatius. Com en tot procés de selecció, aquesta tecnologia primitiva s’hauria anat modificant, sobretot aprenent a no consumir els productes fets malbé amb patògens o compostos tòxics, segurament amb més d’una víctima pel camí.
La fermentació externa dels aliments requereix pocs coneixements, força menys que la utilització del foc, ja que la fermentació és un procés natural que pot passar espontàniament, és un procés passiu per al qual no cal un esforç actiu com el de mantenir el foc. I a més, la fermentació pot preservar els aliments durant molt de temps, anys i tot, gràcies sobretot a alguns productes de la fermentació com l’àcid làctic o l’etanol.
De fet, es proposa que altres espècies de Homo com els Neandertals ja deixaven fermentar carn, amb la qual cosa la baixada de pH degut a l’àcid produït preservava la vitamina C continguda a la carn i així evitaven l’escorbut (Speth 2019).
Segurament la fermentació s’aniria combinant amb altres tècniques de conservació com el fumat, assecat i salat, com es fa actualment. Però la facilitat de la fermentació en molt diversos tipus d’aliments, ambients i condicions devia permetre la seva difusió. La prova més evident és que en l’actualitat hi ha múltiples aliments fermentats, a pràcticament totes les parts del món. Es calcula que hi ha més de 5000 varietats d’aliments fermentats, que segons la FAO són el 35% del mercat actual de tots els aliments. En veiem alguns a la Taula 3 i a la Figura 4. També podem veure una selecció de 36 d’ells a un lloc web d’informació gastronòmica: howtocook.recipes.
Taula 3. Relació d’aliments fermentats, ordenats pels tipus de substrat: parts de vegetals o animals (modificada i ampliada de Bryant et al 2023).
| Nom producte | Substrat | Tipus producte | Lloc d’origen | Microorganismes |
| Kimchi | fulles de col, rave i altres | àcid | Àsia E | Bacteris làctics (BL) |
| Xucrut | fulles de col | àcid | Europa | BL, enterobacteris |
| Pu-erh | fulles de té | àcid, beguda | Àsia E | Floridures, llevats |
| Kombutxa de té | fulles de té | àcid, beguda | Àsia E | Bacteris acètics, llevats |
| Pàmpols per a dolmades | fulles de raïm | àcid | Europa SE | BL |
| Gundruk | fulles de raves, col i altres | àcid | Nepal | BL |
| Sinki | arrel de rave | àcid | Nepal | BL |
| Garri | arrel de mandioca | àcid | Àfrica W | BL, floridures, llevats |
| Sapal | tubercle de taro | àcid | Papua Nova Guinea | BL, llevats |
| Poi | tubercle de taro | àcid | Hawaii | BL |
| Tocosh | patata | àcid | Amèrica S | BL |
| Fufu | arrels de nyam, mandioca | àcid | Àfrica W | BL |
| Natto, Kinema i altres | faves de soia | àlcali | Japó, Àsia E | Bacillus subtilis (més info al meu post) |
| Salsa Gochujang | pebre, arròs, soja, cereals | àcid + dolç picant, condiment | Corea | Bacillus, Enterococcus, cianobacteri Aerosakkonema, floridures |
| Tempeh | faves de soia | àlcali | Indonèsia | Rhizopus |
| Salsa de soia | faves de soia | àlcali + àcid, condiment | Àsia E | Aspergillus oryzae (koji), BL, llevats |
| Miso | faves de soia, cereals | àlcali + àcid, condiment | Japó | Aspergillus oryzae (koji), BL, llevats |
| Oncom | restes de soia, mandioca i altres | àlcali | Indonèsia | Rhizopus, Neurospora |
| Sumbala, Dawadawa | grans de fabàcia néré | àlcali | Àfrica W | Bacillus, BL |
| Café (més info al meu post) | grans de cafè | àcid, beguda | Àfrica E | Enterobacteris, Bacillus, BL i llevats |
| Cacau | grans de cacau | àcid | Amèrica central i S | Llevats, BL i bacteris acètics |
| Olives de taula | fruits | àcid | Mediterrani | BL, llevats |
| Altres vegetals confitats | cogombres, albergínies, raves i altres | àcid | Mediterrani | BL, bacteris acètics |
| Pulque | saba de tija floral del maguei, Agave | alcohol, beguda | Mèxic | Zymomonas, BL, llevats |
| Vi | fruits de raïm | alcohol, beguda | Mediterrani | Llevats, i BL a malolàctica |
| Sidra | poma | alcohol, beguda | Europa W | Llevats |
| Sidra de pera | pera | alcohol, beguda | Regne Unit, França | Llevats |
| Vins de fruita | fruites diverses: cirera, banana i altres | alcohol, beguda | Europa N, Amèrica central | Llevats |
| Vinagre | fruites o cereals | àcid, condiment | Mediterrani | Bacteris acètics |
| Cerveses | grans de cereals | alcohol, beguda | Europa, Àsia W | Llevats |
| Cerveses “àcides”(més info al meu post) | grans de cereals | alcohol + àcid, beguda | Bèlgica, Alemanya | Llevats, BL |
| Kvass | grans de cereals | alcohol + àcid, beguda | Europa E | Llevats, BL |
| Sake, vi d’arròs | grans d’arròs | alcohol, beguda | Japó | Llevats, Aspergillus oryzae (koji) |
| Makgeolli, vi d’arròs coreà | grans de cereals | alcohol, beguda | Corea | Llevats, Aspergillus, BL, proteobacteris |
| Chicha | grans de moresc | alcohol, beguda | Amèrica S | BL, altres bacteris, llevats |
| Massa mare, sourdough | grans de cereals | àcid, massa | Europa, Àsia W, Amèrica N | BL, llevats |
| Appam | arròs, llet coco | àcid, massa | Índia | BL, llevats |
| Idli | arròs i llenties | àcid | Índia | BL |
| Kenkey | grans de moresc | àcid, massa | Àfrica W | BL, llevats |
| Pozol | grans de moresc, cacau | àcid, beguda | Amèrica central | BL, altres bacteris, llevats, floridures |
| Injera | grans de cereals (Eragrostis tef) | àcid, pa | Etiòpia, Àfrica E | BL, Bacillus, enterobacteris, llevats |
| Hidromel, Tej etíop | mel | alcohol, beguda | Àfrica, Àsia, Europa | Llevats |
| Formatges | llet | àcid | Mundial | BL, altres bacteris, llevats, floridures |
| Iogurt i semblants | llet | àcid | Europa E, Àsia W | BL |
| Crème fraiche | llet | àcid | França, Europa | BL |
| Quefir | llet | àcid | Caucas | BL, llevats |
| Kumis | llet d’euga | àcid, alcohol | Àsia central, Amèrica S | BL, llevats |
| Chal | llet de camella | àcid | Àsia central | BL, llevats |
| Leben | llet | àcid | Àfrica N, Àsia W | BL |
| Buttermilk | sèrum de mantega | àcid | Europa, Àsia W | BL |
| Embotits | carn de porc i altres | àcid | Europa | BL, llevats, floridures |
| Pernil | carn de porc | àcid | Europa | BL, altres bacteris, floridures |
| Nem chua | carn de porc, arròs, fulles plàtan | agredolç | Vietnam | BL |
| Satchu | carn | àcid | Himàlaia | BL, altres bacteris, llevats, floridures |
| Pemmican | carn de bisó, cèrvol i altres | àcid | Amèrica N | Diversos bacteris |
| Dodery | ossos animals | àcid | Sudan | Bacillus, altres bacteris, BL, llevats |
| Tiroi | musclos, altre marisc | àcid | Nova Zelanda | Diversos bacteris, BL |
| Kina | eriçons de mar | àlcali | Nova Zelanda | Diversos bacteris |
| Hákarl | carn de tauró | àlcali | Islàndia | Proteobacteris: Moraxella, Acinetobacter |
| Ngari | peix ciprínid | àcid | Índia, Himàlaia | BL, Bacillus, llevats |
| Surströmming | areng | àcid | Suècia, Europa N | Halanaerobium (arqueu), BL, altres bacteris |
| Nam-pla, bagoong i altres | peixos diversos | àcid, condiment | Àsia SE, Filipines, Europa | Bacillus, altres bacteris, arqueus halòfils |
| Garum | vísceres de peix | àcid, condiment | antigues Grècia, Roma, Bizanci | Diversos bacteris i arqueus |
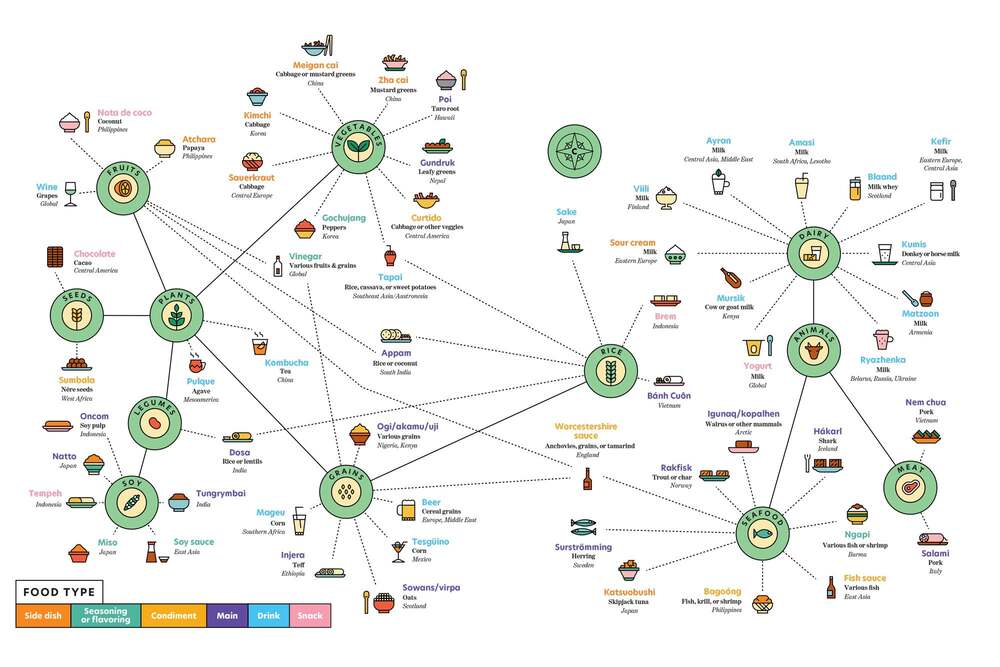
Els aliments fermentats són actualment una part important en la dieta humana a tot arreu, tant en regions on la seguretat alimentària i conservació actualment no estan ben controlades com en les més desenvolupades. És una tecnologia global entre els humans, i per tant és una prova de què prové dels primers humans. Com veiem (Taula 3), els substrats dels aliments poden ser vegetals, de les diferents parts de les plantes, o també de molt diversos animals.
A més, encara que les pràctiques culturals de fermentar aliments són molt variades globalment, sembla clar que en general els aliments fermentats ens agraden als humans. Aquesta preferència hauria emergit en paral·lel a una atracció adaptativa pels aromes i textures pròpies dels aliments fermentats per part dels primers humans. Per això podem observar com hi ha molts d’aquests aliments que són condiments, o sigui que s’afegeixen a altres aliments per tal de millorar la seva palatabilitat (Bryant et al 2023).
Aquesta gran diversitat dels aliments fermentats fa que alguns gustos i aromes ben estranys siguin molt apreciats per unes cultures i detestats per altres, com passa amb alguns formatges molt pudents, amb compostos volàtils amoniacals i de sofre. Hi ha una especificitat cultural en el seu consum. Els mateixos aromes que poden ser senyal de menjar “bo” en una cultura poden ser senyal de menjar dolent o passat en una altra. La capacitat per “degustar” menjars àcids, agres o amargs, gustos no habituals als aliments naturals i absents en altres animals, segurament ha evolucionat als humans amb la producció d’aliments fermentats (Frank et al 2022).
Com vèiem abans (Taules 1 i 2), el desenvolupament de la fermentació externa d’aliments va anar lligada a una pèrdua important de massa del còlon i de l’energia que s’hi produeix, i per tant això implica una reducció en la quantitat i diversitat de la microbiota intestinal perquè aquests no són tan necessaris. Això s’evidencia en fer anàlisis comparatives de la microbiota humana amb la dels altres homínids com ximpanzés, bonobos o goril·les (Moeller et al 2014).
D’altra banda, la preferència dels humans per als aliments fermentats també es demostra amb les anàlisis genètiques. Per exemple, alguns gens de receptors olfactius relacionats amb productes fermentats estan seleccionats positivament als humans i no als ximpanzés, com són els del metil-octanoat, d’olor afruitat produït pels llevats de vinificació, o del metilvalèric, aroma clau dels formatges madurats.
La capacitat de metabolitzar l’etanol produït a la fermentació alcohòlica i per tant poder consumir-lo en moderació és deguda a unes variants gèniques que codifiquen per a l’alcohol deshidrogenasa (ADH7), que lògicament s’haurien impulsat en els primers humans amb les primeres begudes obtingudes per fermentació. Tanmateix, sembla que aquesta capacitat seria prèvia als humans, ja que els altres grans primats la tenen, i fins i tot altres mamífers com alguns quiròpters. Tots ells són consumidors de fruites, que poden ser fermentades espontàniament a la natura, i per tant tots aquests animals haurien adquirit aquesta capacitat en consumir fruites que han estat parcialment fermentades (Janiak et al 2020). Així doncs els homínids ja estarien adaptats a metabolitzar l’etanol molt abans que els primers humans ho fessin de forma més dirigida (Carrigan et al 2015).
CONCLUSIÓ
Crec que aquesta hipòtesi de la fermentació externa dels aliments com a element clau en l’expansió del cervell observada en l’evolució des dels australopitecs als humans és molt versemblant. La fermentació dels aliments en molts casos és quasi espontània, inicialment requereix molt poca tecnologia i coneixements, i amb una mínima selecció dels productes resultants després de la fermentació, s’obtenen aliments més digeribles, i que es conserven millor, i que tenen gustos o textures nous i interessants.
Aquest desenvolupament dels aliments fermentats va permetre que no calgués tenir un volum considerable de còlon amb la seva microbiota tan diversa, per adquirir nutrients que es poden consumir elaborant-los prèviament. En reduir-se les necessitats calòriques del còlon, l’energia “sobrant” va poder ser dedicada cada cop més al cervell, facilitant-ne la seva expansió. Lògicament i en paral·lel, o en alguns casos posteriorment, els altres factors comentats com el consum de carn, noves tecnologies de cacera, socialització, i el foc, van permetre encara més aquest engrandiment del cervell, fins arribar als Homo sapiens.
Finalment, només vull comentar que aquest treball m‘ha agradat especialment perquè tot plegat lliga tres dels temes que més m’atrauen científicament:
1) Aliments fermentats, o tal com a l’article de Bryant et al es diu, “fermentació externa”. De fet aquest denominació d’externa m’ha sorprès, ja que no havia pensat mai en anomenar “fermentació interna” al conjunt de processos de modificació o degradació o síntesi de compostos que du a terme la microbiota intestinal. Però vaja, és veritat. En qualsevol cas, els aliments fermentats i els aspectes dels beneficis dels microorganismes (“els microbis bons”) han estat sempre el meu tema primordial de treball de recerca, i de docència, i d’interès des que vaig acabar la llicenciatura de Biologia, ara fa 50 anys.
2) Microbiota intestinal. Des de fa uns quants anys és un tema que m’interessa molt. Encara que no l’he treballat directament a nivell de recerca, sí que he anat coneixent-lo, i el toco una mica a nivell docent. Com estem veient aquests darrers anys el paper de la microbiota intestinal en el manteniment saludable del cos és molt més important del que ens pensàvem, si bé encara falta molt per conèixer. Curiosament i una mica decebut, he descobert amb aquest treball, que els humans hem prescindit una mica de la microbiota intestinal i l’hem reduït en comparació als altres primats, justament amb el desenvolupament d’aquesta “fermentació externa”.
3) Origen i evolució humana. Per descomptat, aquest tema m’interessa molt, com suposo que a tothom. Amb un cert coneixement dels sers vius i admirant com funciona tota l’evolució biològica, saber més de com va aparèixer la nostra espècie i les properes, és apassionant.
BIBLIOGRAFIA
Alexander C, Swanson KS, Fahey GC, Garleb KA (2019) Perspective: physiologic importance of short-chain fatty acids from nondigestible carbohydrate fermentation. Adv Nutr 10, 576–589
Amato KR, Chaves OM, Mallott EK et al (2021) Fermented food consumption in wild nonhuman primates and its ecological drivers. Am J Phys Anthropol 175, 513–530
Bryant KL, Hansen C, Hecht EE (2023) Fermentation technology as a driver of human brain expansion. Commun Biol 6, 1190
Bunn HT, Ezzo J (1993) Hunting and Scavenging by Plio-Pleistocene Hominids: Nutritional Constraints, Archaeological Patterns, and Behavioural Implications. J Archaeol Sci 20, 365-398
Carrigan MA, Uryasev O, Frye CB et al (2015) Hominids adapted to metabolize ethanol long before human-directed fermentation. Proc Natl Acad Sci USA 112, 458–463
Cordain L, Eaton S, Miller J et al. (2002) The paradoxical nature of hunter-gatherer diets: meat-based, yet non-atherogenic. Eur J Clin Nutr 56, S42–S52
Dyer R (2023) Food preserving technique may have sparked human brain growth, scientists say. Science Alert – Humans, 3/12/2023
Frank HER, Amato K, Trautwein M et al. (2022) The evolution of sour taste. Proc. Biol. Sci. 289, 20211918
Goren-Inbar N, Alperson N, Kislev ME et al. (2004) Evidence of Hominin Control of Fire at Gesher Benot Ya`aqov, Israel. Science 304,725-727
Hlubik S, Cutts R, Braun DR et al (2019) Hominin fire use in the Okote member at Koobi Fora, Kenya: New evidence for the old debate. J Human Evol 133, 214-229
Janiak MC, Pinto SL, Duytschaever G et al (2020) Genetic evidence of widespread variation in ethanol metabolism among mammals: revisiting the ‘myth’ of natural intoxication. Biol. Lett. 16, 20200070
Mann N (2000) Dietary lean red meat and human evolution. Eur J Nutr 39, 71–79 (2000)
Marean C, Bar-Matthews M, Bernatchez J. et al (2007) Early human use of marine resources and pigment in South Africa during the Middle Pleistocene. Nature 449, 905–908
McClave SA, Snider HL (2001) Dissecting the energy needs of the body. Curr Opin Clin Nutr Metab Care 4(2):143-7
Miller IF, Barton RF, Nunn CL (2019) Quantitative uniqueness of human brain evolution revealed through phylogenetic comparative analysis. eLife 8:e41250
Moeller AH, Li Y, Ngole EM et al (2014) Rapid changes in the gut microbiome during human evolution. Proc Natl Acad Sci USA 111, 16431–16435
O’Hara AM, Shanahan F (2006) The gut flora as a forgotten organ. EMBO Rep 7, 688–693
Padmaja G, Steinkraus KH (1995) Cyanide detoxification in cassava for food and feed uses. Crit Rev Food Sci Nutr 35, 299–339
Ponce de León MS, Bienvenu T, Marom A et al. (2021) The primitive brain of early Homo. Science 372, 165-171
Ohland CL, Macnaughton WK (2010) Probiotic bacteria and intestinal epithelial barrier function. Am J Physiol Gastrointest Liver Physiol 298, G807–19
Sandhu KS, Punia S, Kaur M (2017) Fermentation of cereals: a tool to enhance bioactive compounds. Plant biotechnology: Recent advancements and developments 157, 157–170
Speth JD (2019) Neanderthals, vitamin C, and scurvy. Quat. Int. 500, 172–184
Wrangham RW, Jones JH, Laden G et al. (1999) The Raw and the Stolen: Cooking and the Ecology of Human Origins. Curr Anthrop 40:5, 567-594
Un bon cafè, amb cafeïna
20 octubre 2023
El cafè és la popular beguda amarga però estimulant obtinguda per infusió dels grans de cafè torrats i molts. Els grans són les dues llavors, les meitats de cada fruit carnós —com una cirera petita— de l’arbust del cafè (Figura 1), o també “cafeto” en castellà, de diverses espècies del gènere Coffea.
El cafè és la segona mercaderia més comercialitzada al món després del petroli, i és la beguda estimulant més consumida arreu del món, després del te. El cafè fou conreat i consumit originàriament a la península aràbiga i el nord d’Etiòpia el segle 15, i des del món àrab s’estengué després per Europa, Amèrica i la resta del món. Actualment hi ha més de 50 països productors i dona ocupació a uns 25 milions de persones.
Per obtenir el cafè, després de recollir els fruits ben madurs, aquests són sotmesos a un primer procés natural, o bé sec, o semisec o humit, que inclou una fase de fermentació. En la majoria dels casos aquesta és espontània, amb la intervenció de molt diversos microorganismes, sobretot d’alguns enterobacteris, Bacillus, bacteris làctics i llevats. Les activitats pectinolítiques microbianes contribueixen a que en el rentat que es fa a continuació sigui eliminada la pell i el mucílag dels fruits, quedant-se només amb les llavors o grans de cafè. Altres reaccions metabòliques microbianes durant la fermentació contribueixen a les quailitats sensorials del cafè. En el processat final, els grans de cafè són torrats i assecats (Elhalis et al 2023).

Figura 1. Fruits en diversos estadis de maduresa, de l’arbust de cafè (“cafeto”), del gènere Coffea (Foto de Fernando Rebelo, Wikimedia Commons).
La cafeïna és l’alcaloide amargant i estimulant característic del cafè. Recordem que els alcaloides són compostos orgànics naturals de caràcter bàsic o àlcali que contenen un o més àtoms de nitrogen en estructures normalment d’heterocicle. Tanmateix, com que a la biosíntesi de la cafeïna no s’incorpora cap aminoàcid, alguns autors prefereixen anomenar-la com a pseudo-alcaloide (Lim & Farah 2019).
La cafeïna és una de les tres xantines —bases puríniques— metilades (Figura 2), junt amb la teobromina i la teofil·lina. Les tres són presents a diferents espècies de plantes, com veurem tot seguit. Les xantines són bases puríniques, com la guanina i l’adenina dels àcids nucleics.
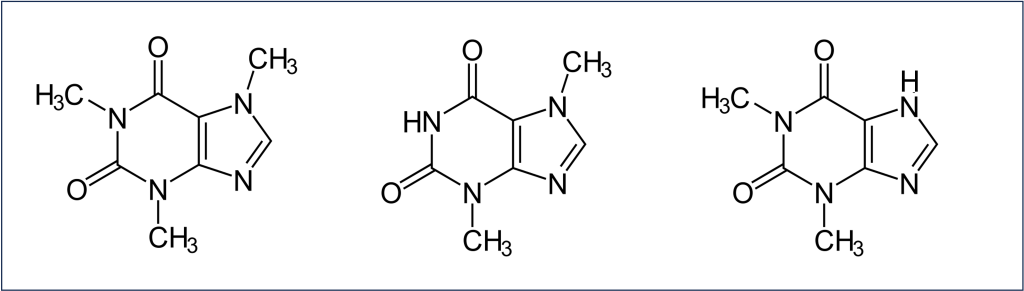
Figura 2. Les xantines —bases puríniques— metilades: cafeïna (esquerra, 1,3,7-trimetilxantina), teobromina (mig, 3,7-dimetilxantina) i teofil·lina (dreta, 1,3-dimetilxantina).
La cafeïna és força soluble i s’extreu bé durant la preparació del cafè. Un cop consumit aquest, la cafeïna és completament absorbida i és metabolitzada al fetge pels enzims de les cadenes de transport d’electrons del citocrom P450, especialment CYP1A2, que té una distribució polimòrfica als humans. El principal metabòlit al fetge són les altres xantines metilades teobromina i teofil·lina, al plasma és la paraxantina, i les formes d’excreció a l’orina són les xantines metilades i l’àcid metilúric (De Paula & Farah 2019).
La cafeïna és la droga psicoactiva més consumida al món, ja que, a diferència de moltes altres substàncies psicoactives, no està regulada i és legal a pràcticament tot el món. Es coneixen diversos mecanismes d’acció per explicar els efectes de la cafeïna. El més destacat és que evita els efectes de somnolència induïts per l’adenosina, bloquejant reversiblement l’acció d’aquesta sobre els seus receptors, perquè la cafeïna té una estructura tridimensional similar a la de l’adenosina. La cafeïna és, a més, estimulant de certes regions del sistema nerviós autònom (Nehlig et al 1992).
——————————————–
BIOSÍNTESI DE CAFEÏNA PER LES PLANTES
La biosíntesi de cafeïna per les plantes és un dels casos més importants de convergència evolutiva, on organismes evolutivament diferenciats arriben a sintetitzar una mateixa molècula o a desenvolupar un òrgan. En el cas de la cafeïna, sembla que al llarg de l’evolució ha aparegut 5 cops en diferents fanerògames, en unes 30 espècies (Taula 1) (Ashihara & Suzuki 2004). A més de les plantes del cafè, te, mate, cola, cacau, veiem altres no tan conegudes, i fins i tot els cítrics, que la contenen a les flors (Kretschmar & Baumann, 1999).
Taula 1. Principals espècies de plantes que contenen cafeïna i/o teobromina (modificat de Ashihara & Suzuki 2004)
| Espècie | Nom comú | Lloc conreu | Alcaloide principal | Part de planta |
| Coffea arabica | Cafè aràbic (60% del total) | Origen Aràbia i Etiòpia; actual ídem, Àfrica, sud i centre Amèrica, sud-est Àsia, Índia, Xina | Cafeïna 1.5% | llavors (2) del fruit |
| Coffea canephora (sin. C. robusta) | Cafè robust (20% del total) | Origen Àfrica subsahariana; actual ídem, Vietnam, Brasil | Cafeïna 2.7% | llavors (2) del fruit |
| Camellia sinensis | Te | Àsia i Àfrica oriental | Teïna (=cafeïna) 2%, traces de teobromina i teofil·lina | fulles |
| Cola acuminata, C. nitida | Cola | Àfrica occidental | Cafeïna 2% | fruit (nous) |
| Ilex paraguarensis | Herba mate | Conques Paranà i Paraguay | Guaranina (=cafeïna) 1.5% | fulles |
| Paullinia cupana | Guaranà | Amazones | Guaranina (=cafeïna) 3% | llavors |
| Theobroma cacao | Cacau | Àfrica occidental, Indonèsia, Sud-Amèrica | Teobromina | fruit (faves) |
| Ilex vomitoria | Yaupon (espècie de grèvol) | Costa nord del golf Mèxic | Cafeïna i teobromina | fulles i tiges |
| Ilex guayusa | Guayusa | Amazones | Cafeïna i teobromina | fulles |
| Citrus sp. | Cítrics diversos | Climes mediterranis | Cafeïna 0.9% | flors |
Com veiem, el contingut en cafeïna d’algunes altres plantes com el te és similar al del cafè (un 2% enfront de 1.5-2.7%). L’aparent major efecte estimulant del cafè és degut a què els tanins del te fan que l’absorció de la “teïna” (cafeïna) sigui més lenta a través de l’intestí prim. L’efecte és més lent però també dura més.
Veiem a la mateixa Taula 1 com a més de la cafeïna, moltes d’aquestes plantes com el te, el cacau i altres, contenen també les altres dues xantines metilades, teobromina i teofil·lina. Les percepcions diferents dels efectes de les diferents begudes són degudes als continguts d’aquestes altres xantines, així com els esmentats tanins i altres polifenols que formen complexos insolubles amb la cafeïna.
RUTA BIOSINTÈTICA DE LA CAFEÏNA
La ruta biosintètica específica de la cafeïna i les altres xantines metilades a les plantes (Figura 3) s’origina al ribonucleòsid xantosina, la qual se sintetitza a partir d’adenosina passant pels nucleòtids monofosfats d’adenosina (AMP), d’inosina (IMP) i de xantosina (XMP), intermediaris en el metabolisme de les purines. Des de la xantosina hi han successius passos de metilació amb la S-adenosil-metionina com a donador de grups metil, a més de la nucleosidasa que elimina la ribosa deixant la base purínica.
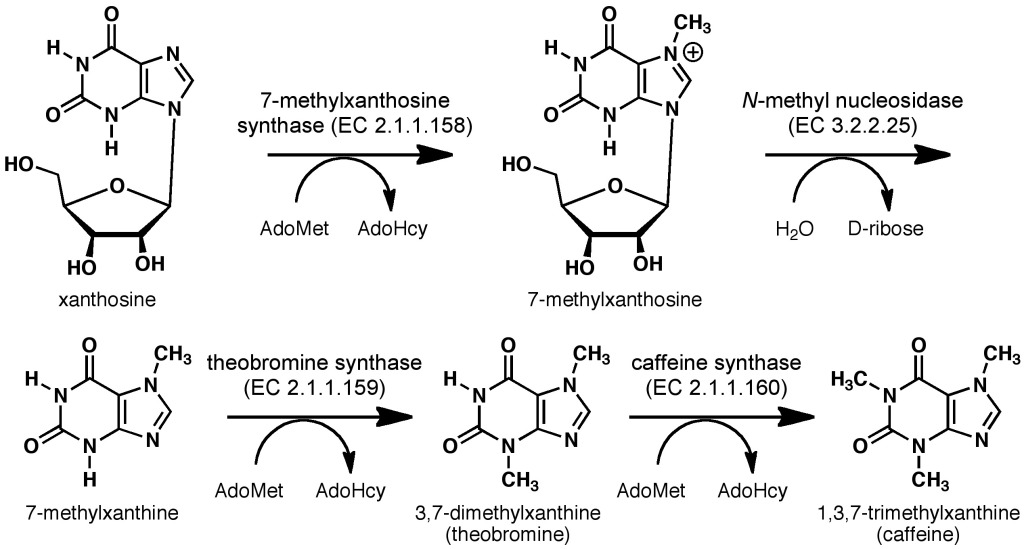
Figura 3. Ruta biosintètica específica de la cafeïna a diferents espècies de Coffea i Camellia. AdoMet és el donador de grups metil S-adenosil-metionina i AdoHcy és S-adenosil-homocisteïna. (Imatge de Boghog, Wikipedia).
I PERQUÈ SINTETIZEN CAFEÏNA AQUESTES PLANTES ?
La cafeïna és clarament un metabòlit secundari, ja que no té cap funció interna pròpia a l’organisme que el sintetitza, la planta en aquest cas. I en canvi, té funcions d’interrelació de la planta amb altres organismes. En efecte, la cafeïna actua com a pesticida natural: pot paralitzar i matar insectes depredadors alimentats a la planta (Nathanson 1984). Es troben nivells elevats de cafeïna a les plàntules de cafè quan desenvolupen fullatge i no tenen protecció mecànica. O sigui, les concentracions són més altes a les parts de la planta del cafè en desenvolupament, quan són més vulnerables i més tendres per poder ser menjades pels insectes. A més s’ha vist que la cafeïna també és efectiva contra llimacs, cargols, i alguns fongs i bacteris (PBS Eons 2023).
En el cas del te la cafeïna s’emmagatzema a les fulles de te en dos llocs. En primer lloc, als vacúols cel·lulars on s’acomplexa amb polifenols. Aquesta cafeïna probablement s’allibera a les parts de la boca dels insectes, per descoratjar l’herbívor. En segon lloc, s’acumula al voltant dels feixos vasculars, on probablement inhibeix els fongs patògens d’entrar i colonitzar aquests feixos vasculars (Van Breda et al 2013).
PERÒ LA CAFEÏNA AGRADA A ALGUNS INSECTES
Tanmateix, hi ha un insecte que és resistent a la cafeïna: el coleòpter Hypothenemus hampei, l’escarabat barrenador del cafè, que causa estralls a les plantacions i és una plaga estesa a nivell mundial. Aquest insecte és l’únic capaç de completar el seu cicle biològic exclusivament amb els grans de cafè, i aquesta habilitat és deguda a la seva microbiotaintestinal. S’ha comprovat que la cafeïna és degradada per aquesta microbiota, amb bacteris que tenen gens per a la desmetilasa. En destaquen alguns Pseudomonas que fins i tot poden subsistir amb cafeïna com a única font de carboni i nitrogen (Ceja-Navarro et al 2015).
D’altra banda, la poca cafeïna que es troba al nèctar de les flors de la planta del cafè i dels cítrics pot millorar l’èxit reproductiu de la planta, millorant la memòria de recompensa de pol·linitzadors com les abelles de la mel (Wright et al 2013). L’efecte atractiu que perceben les abelles en aquest cas, a diferència de l’efecte tòxic d’altres parts de la planta, s’explica per la baixa concentració de cafeïna al polen (0.02 mM com a molt), molt més baixa que a les llavors o fulles (més de 0.2 mM).
——————————————–
I EL CAFÉ AGRADA ALS HUMANS, PERÒ ÉS DOLENT O ÉS BO ?
Com he comentat abans, el cafè és el producte més comercialitzat al món després del petroli, perquè ens agrada a quasi tots els humans, i molt. El motiu principal és que conté cafeïna, una droga psicoactiva, la més consumida al món —ja que cal afegir-hi la que contenen el te, cacau, cola, etc.— i que és legal a quasi tot els països.
El cafè ens agrada per diversos motius, però sobretot perquè la cafeïna és un estimulant del sistema nerviós central. És un compost eugeroic, o sigui, que afavoreix l’estat de vigília i alerta, reduint la fatiga i la somnolència. Amb això, augmenta el rendiment en les activitats cognitives com l’estudi o el treball intel·lectual. I a més el seu consum també és un mitjà d’interrelacions socials de lleure. A més, és diürètic, i també contribueix a combatre el restrenyiment i facilitar les digestions.
Tots aquests efectes són atribuïts a la cafeïna però cal tenir en compte que el cafè és una mescla complexa de més de 800 compostos volàtils, i molts d’ells també són constituents bioactius del cafè, com els diterpens, els àcids clorogènics, i altres polifenols —tots ells antioxidants—, els quals tenen efectes potencials additius o sinèrgics amb la cafeïna (Nieber 2017).

Però anem al “gra” …. el cafè és dolent o és bo per a la salut ?
Aquests darrers anys s’han anat realitzant nombrosos estudis epidemiològics i de cerca experimental farmacològica, així com revisions dels molts treballs efectuats prèviament, i les conclusions són majoritàriament favorables, que els riscos són menors que els beneficis, i que fins i tot el consum de cafè podria ajudar a prevenir algunes malalties cròniques com la diabetis tipus 2 mellitus i algunes hepatitis. Amb un consum moderat de cafè en adults, unes 3-4 tasses al dia (uns 300-400 mg/d) hi ha poques evidències de riscos per a la salut i en canvi hi ha algunes evidències de beneficis. Cal senyalar que en part s’ha vist que el cafè descafeïnat pot tenir efectes beneficiosos similars, la qual cosa remarca la contribució d’altres components com els suara comentats, a banda de la cafeïna, en aquests efectes beneficiosos (Nieber 2017).
En tots aquests estudis s’ha confirmat que hi ha moltes diferències individuals en la resposta al cafè. Hi ha persones més sensibles que altres a aquests efectes, degut a la tolerància, la base genètica —com el polimorfisme CYP2A1—, l’edat, el sexe, l’alimentació, el tipus de preparació del cafè, el volum, l’estil de vida, l’estat de salut, el consum de tabac i altres drogues, així com si el cafè es pren habitualment o no. En qualsevol cas, el consens científic actual és que el consum moderat habitual de cafè per persones sanes és benigne o no té cap efecte detectat o és lleugerament beneficiós, i aquests beneficis superen clarament els possibles riscos (Pourshahidi et al 2016).
Les conclusions més rellevants de les revisions de tots els centenars d’estudis científics fets sobre els efectes del cafè —no només la cafeïna— sobre la salut en quant als diferents òrgans o sistemes o situacions del cos humà són les següents (Samoggia & Riedel 2019) :
Malalties cardiovasculars: El consum habitual de cafè s’ha correlacionat amb un menor risc de mortalitat per malalties cardiovasculars, un 19% menys en consumidors de 3 tasses/dia que als que no prenen cafè. Aquest efecte s’ha atribuït sobretot als efectes antioxidants de compostos del cafè.
Diabetis tipus 2: La probabilitat de desenvolupar aquesta diabetis és un 25% menor en els consumidors de cafè que en els no consumidors, amb un major efecte a les dones. Aquest efecte s’ha atribuït als polifenols que actuen sobre el metabolisme de la glucosa i la insulina.
Malalties hepàtiques: S’ha observat una correlació inversa entre el consum de cafè i diverses afeccions hepàtiques, i especialment amb el càncer de fetge. Això sembla degut als efectes antioxidants de la cafeïna, els compostos fenòlics, i les melanoidines.
Desordres neurodegeneratius: El consum moderat, regular i al llarg de la vida del cafè sembla tenir efectes beneficiosos per evitar malalties neurodegeneratives relacionades amb l’edat, com la demència senil o l’Alzheimer. En aquest cas sembla que estaria relacionat amb efectes neuroprotectors de la mateixa cafeïna.
Càncer: Com que anys enrere hi havia hagut alguns estudis que apuntaven a un possible efecte mutagen i per tant carcinogènic de la cafeïna, el 2016 l’Agència Internacional de Recerca en Càncer va avaluar un conjunt de 1000 estudis experimentals sobre aquesta possible relació i van concloure que no hi havia cap evidència d’associació entre càncer i consum de cafè, i per tant que el cafè és un agent no classificable com carcinogen per als humans. Fins i tot hi ha una certa relació entre consum notable de cafè i menor risc de càncer, com el cas comentat del fetge. Diversos compostos com la cafeïna, diterpens, melanoidines i polifenols serien els inhibidors de l’estrès oxidatiu i danys cel·lulars.
Augment de la pressió sanguínia: Sovint s’ha associat el consum de cafè amb aquest augment, encara que això s’ha trobat més en no bevedors de cafè que en consumidors habituals. Els compostos antioxidants com els polifenols contrarestarien l’efecte d’augment de pressió provocat per la cafeïna, si bé encara no hi ha prou evidències al respecte.
Embaràs: En diversos estudis s’havia associat el consum de cafè/cafeïna amb perjudicis per a l’embaràs com baix pes del nadó, avortaments o naixements pre-termini, però en revisar bé tots els estudis, la EFSA (Autoritat Europea de Seguretat Alimentària) ha conclòs que un consum moderat de cafeïna de 200 mg/dia (unes 1-2 tasses) no augmenta el risc de complicacions de l’embaràs.
I ja per concloure, i encara que aquestes revisions publicades (Pourshahidi et al 2016; Nieber 2017; Samoggia & Riedel 2019) remarquen que calen més estudis i sobretot en assajos de consum de cafè més perllongat, sembla que prendre cafè globalment no és dolent per a la salut i com sabem el fet de prendre’n té molts altres beneficis.
Visca una bona tassa, o tasseta, de cafè !!
——————————————–
BIBLIOGRAFIA
Ashihara H, Suzuki T (2004) Distribution and biosynthesis of caffeine in plants Front Biosci (Landmark Ed), 9(2), 1864–1876
Ceja-Navarro J, Vega F, Karaoz U et al (2015) Gut microbiota mediate caffeine detoxification in the primary insect pest of coffee. Nature Commun 6, 7618
De Paula J, Farah A (2019) Caffeine Consumption through Coffee: Content in the Beverage, Metabolism, Health Benefits and Risks. Beverages 5(2):37
Elhalis H, Cox J, Zhao J (2023) Coffee fermentation: Expedition from traditional to controlled process and perspectives for industrialization. Appl Food Res 3, 100253.
Huang R, O’Donnell AJ, Barboline JJ, Barkman TJ (2016) Convergent evolution of caffeine in plants by co-option of exapted ancestral enzymes}. Proc Nat Acad Sci 113, 10613-10618
Kretschmar JA, Baumann TW (1999) Caffeine in Citrus flowers. Phytochemistry 52, 19-23
Lim JP, Farah A (2019) Caffeine and minor methylxanthines in coffee. InCoffee: Consumption and HealthImplications; Farah, A., Ed.; Royal Society of Chemistry: London, UK. ISBN 978-1782620044
Nathanson JA (1984) Caffeine and Related Methylxanthines: Possible Naturally Occuring Pesticides. Science, 226, 4671, 184-187
Nehlig A, Daval JL, Debry G (1992) Caffeine and the central nervous system: mechanisms of action, biochemical, metabolic and psychostimulant effects. Brain Res Rev 17, 139-170.
Nieber K (2017) The Impact of Coffee on Health. Planta Med 83(16): 1256-1263
PBS Eons (2023) Why does caffeine exist ? YouTube video.
Pourshahidi LK, Navarini L, Petracco M, Strain JJ (2016) A Comprehensive Overview of the Risks and Benefits of Coffee Consumption. Comprehensive Rev Food Sci Food Safety 15: 671-684
Samoggia A, Riedel B (2019) Consumers’ Perceptions of Coffee Health Benefits and Motives for Coffee Consumption and Purchasing. Nutrients 18;11(3):653
Van Breda SV, van der Merwe CF, Robbertse H et al. (2013) Immunohistochemical localization of caffeine in youngCamellia sinensis O. Kuntze (tea) leaves. Planta 237, 849–858
Wikipedia: Caffeine (2023) The Free Encyclopedia, Wikimedia Foundation
Wright GA, Baker DD, Palmer MJ et al (2013) Caffeine in Floral Nectar Enhances a Pollinator’s Memory of Reward. Science 339,1202-1204
Trichodesmium, el fixador de nitrogen més important al mar, i molt més
14 juny 2023
Click here for the English version: Trichodesmium is the most important nitrogen-fixing cyanobacteria
El gènere Trichodesmium és un dels cianobacteris més importants des de diversos punts de vista: és prolífic als oceans, hi fixa la meitat del nitrogen atmosfèric necessari per a tota la cadena alimentària, és fotosintètic, és colonial i forma flocs que es desplacen verticalment entre la superfície i fins a 200 m, contribuint als cicles biològics del nitrogen, carboni, fòsfor i del ferro.
ELS CIANOBACTERIS SÓN ORGANISMES CLAU A L’EVOLUCIÓ I A L’ECOLOGIA DE LA TERRA
Abans eren coneguts com a “algues verd-blaves” o cianofícies, per la seva semblança amb les algues, essent fotosintètics autòtrofs i d’aspectes filamentosos, i encara se’ls anomena vulgarment com un tipus de microalgues. Tanmateix, els cianobacteris són procariotes, i per tant no tenen res a veure estructuralment i filogenèticament amb les algues, ja que aquestes són eucariotes.
Són un dels principals fílums dels bacteris, dins el supertàxon Terrabacteria. Vegeu al respecte el meu article sobre els principals fílums bacterians. De fet, són uns dels bacteris més antics, amb fòssils de fa 3500 milions d’anys. Els cianobacteris van “inventar” la fotosíntesi oxigènica, per fotofosforilació no cíclica, amb 2 fotosistemes i clorofil·la, a diferència d’altres bacteris fotosintètics anoxigènics, amb només un fotosistema i bacterioclorofil·les. L’oxigen que anaren produint els cianobacteris, sobretot entre fa 2400 i 2000 milions d’anys, va generar l’atmosfera actual amb un 21% O2. I de fet ells són l’origen evolutiu dels primers cloroplasts i altres plastidis presents a algues i plantes, els eucariotes que aparegueren després, ja que els cianobacteris foren incorporats per endosimbiosi als primers eucariotes.
Són gramnegatius i tenen membranes internes, anomenades tilacoides, on s’acumulen els pigments i on té lloc la fotosíntesi. Són un fílum gran i molt divers, amb molts tipus de formes, tant unicel·lulars, como colonials i moltes filamentoses (Figura 1). Els cianobacteris prosperen en molt diversos hàbitats per tota la Terra i són els principals contribuïdors als cicles biogeoquímics globals. Molts d’ells a més de ser fotosintètics, són fixadors de N2 atmosfèric —diazòtrofs—, convertint-lo a amoni i/o nitrits i nitrats. Alguns fan la fixació de nitrogen en cèl·lules especialitzades, com els heterocists d’Anabena i altres gèneres (Figura 1). Hi ha molts fixadors de N2 de vida lliure però també n’hi ha de simbiòtics amb les arrels de les plantes, anomenats cianobionts, com el mateix Anabaena.
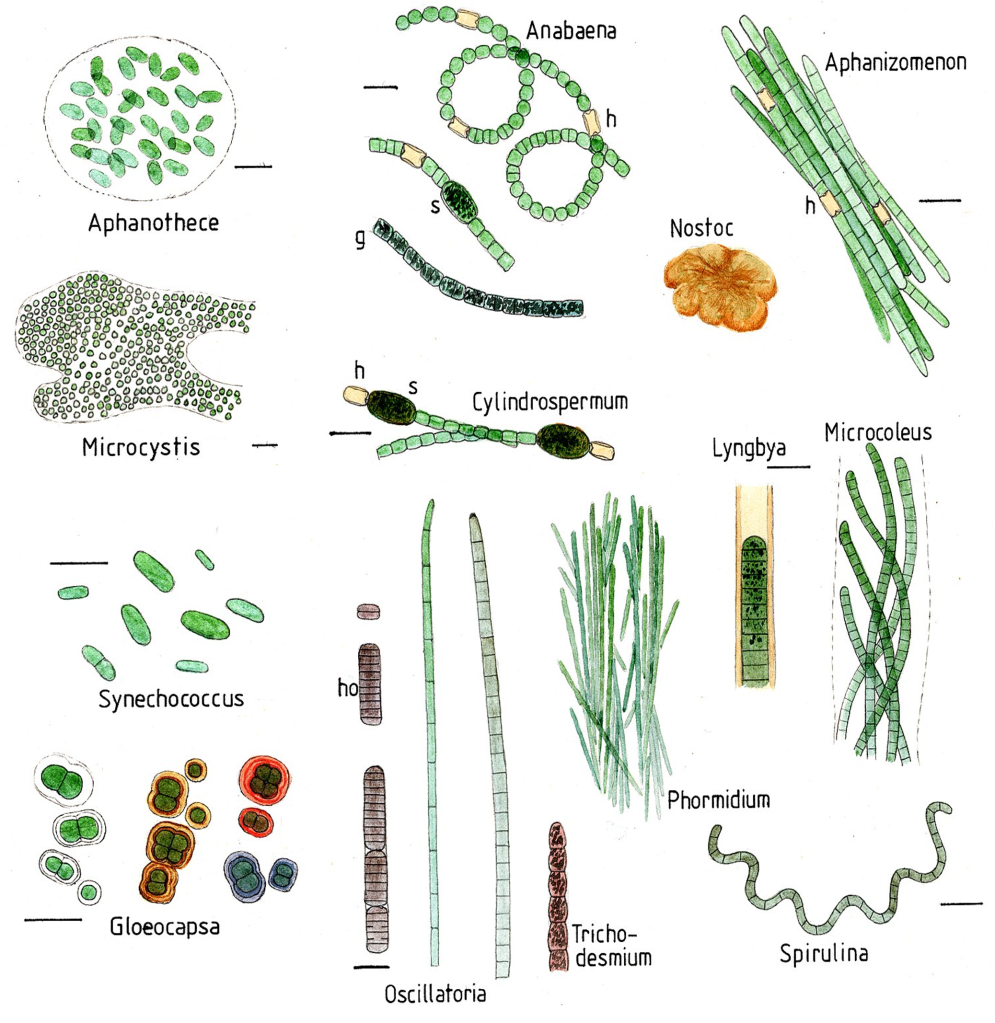
A banda de trobar-se en ambients terrestres i aigües superficials, els cianobacteris són ubics als ambients marins, on tenen un paper important com a productors primaris, part del fitoplàncton. Els principals cianobacteris de mar obert són Crocosphaera, Trichodesmium, Synechococcus i Prochlorococcus. Aquests 2 darrers gèneres són dels anomenats picobacteris, perquè són molt petits, de només 0.5-0.8 μm, i malgrat la seva mida són els organismes més abundants a la Terra: uns 105 bacteris per cada mL d’aigua marina, sobretot a totes les regions oligotròfiques (amb pocs nutrients) dels oceans. Es calcula que només els Prochlorococcus produeixen el 20% de l’oxigen atmosfèric (Partensky et al 1999).
Els cianobacteris marins també són presents a l’anomenat aeroplàncton atmosfèric que es forma amb les esquitxades de les onades, mitjançant el qual aquests bacteris són transportats a altres regions. Alguns cianobacteris poden formar proliferacions algals nocives (blooms) —per excés de nutrients de fertilitzants o residus amb altes temperatures— que al seu torn provoquen desequilibris de l’ecosistema i poden produir toxines, les cianotoxines (Huisman et al 2018).
Biotecnològicament, els cianobacteris són importants com a organismes model d’estudi dels mecanismes fotosintètics i potencials aplicacions. A més, són coneguts —a banda d’alguns productes del metabolisme secundari— per la seva utilització com a menjar, o sigui l’anomenada “proteïna unicel·lular” (Single Cell Protein, SCP) o proteïna microbiana. Gèneres com Arthrospira (abans Spirulina) o Aphanizomenon són utilitzats com a suplements dietètics i tenen efectes positius sobre la salut. Ho podeu veure al meu article sobre la carn alternativa.
TRICHODESMIUM
És un gènere de cianobacteris filamentosos, que es troba en aigües oceàniques tropicals i subtropicals pobres en nutrients, com al mar Roig i als mars d’Austràlia, on fou descrit en primer lloc al segle 18 per l’explorador anglès capità James Cook. De fet, el mar Roig té aquest nom pel color rogenc que s’observa a vegades degut a la proliferació de T. erythraeum i altres espècies semblants. T. erythraeum és la més estudiada i la única seqüenciada fins ara d’aquest gènere. El seu genoma de 7.75 Mb és un dels més grans de tots els bacteris seqüenciats. Una altra espècie ben coneguda per les proliferacions en superfície és T. thiebautii.
Els filaments de Trichodesmium són cadenes d’unitats cel·lulars separades per septes (Figura 2). Els filaments s’anomenen tricomes —mateix nom (pèls en grec) que els fins apèndixs o pèls de plantes i algues. Els tricomes s’agrupen formant flocs de fins a 2 mm, visibles a simple vista (Figura 3), i la seva acumulació a la superfície marina en forma de bandes és visible des de l’espai (Figura 4). Per aquest aspecte també són anomenats “serradures marines” o també “camins de sorra”. De fet, el nom d’aquest gènere prové del grec Trichos = pèls, i Desmos = bandes, o sigui bandes de pèls.
Les colònies de Trichodesmium són un substrat preferent de nombrosos altres organismes oceànics, incloent altres bacteris, protistes com diatomees, dinoflagel·lats, protozous, i sobretot els copèpodes (crustacis, animals). Per tant, aquest gènere és el pilar substancial de complexos microambients marins.



———————
LA FIXACIÓ DE NITROGEN PER TRICHODESMIUM
La recerca feta en diversos estudis els darrers anys ha fet palesa la substancial contribució del cianobacteri diazòtrof Trichodesmium a la captació de nitrogen atmosfèric als ecosistemes marins globals i la cabdal importància ecològica d’aquest gènere (Capone et al 1997; Bergman et al 2013).
Amb la seva gran capacitat de fixar N2 atmosfèric, Trichodesmium és el principal diazòtrof entre els cianobacteris i també el principal organisme diazòtrof dels sistemes pelàgics marins. És una font important de “nou” nitrogen a les aigües pobres en nutrients que habita, produint la meitat del nitrogen que cal per a la producció primària als oceans (MicrobeWiki 2010). L’aportació global de fixació de nitrogen per Trichodesmium és d’aproximadament 60-80 Tg —Teragrams (1012 g), o sigui megatones— de N per any.
Com sabeu, la fixació biològica de nitrogen atmosfèric només la poden fer bacteris, i consisteix en la reducció de N2 —molt inert, cal molta energia per reduir-lo— a 2 molècules de amoni mitjançant un complex enzimàtic, la dinitrogenasa, en un seguit de reaccions semblants a una cadena de transport d’electrons amb piruvat com a donador d’e–, on intervenen una flavodoxina oxidoreductasa i el complex dinitrogenasa pròpiament, amb requeriment d’uns 24 mols ATP per mol N2 fixat. Com que la nitrogenasa és inhibida per l’oxigen, els organismes diazòtrofs tenen diversos mecanismes de poder fixar el nitrogen sense la presència d’oxigen:
- Ser anaeròbics, com alguns clostridials i també alguns fotosintètics anoxigènics.
- Aeròbics que consumeixen ràpidament l’O2 —anomenada protecció respiratòria—, com Azotobacter, que té una citocrom-oxidasa molt activa, i així no hi ha oxigen lliure.
- Aeròbics amb cèl·lules especialitzades que contenen la nitrogenasa, com els heterocists de molts cianobacteris (ex. Anabaena, Figura 1) que impedeixen l’entrada d’oxigen. A més, donat que els cianobacteris són fotosintètics oxigènics, estan produint oxigen, i per tant, cal tenir la nitrogenasa aïllada en aquests heterocists, que fixen nitrogen i no fan fotosíntesi.
- Aeròbics simbiòtics de plantes, com Rhizobium dels nòduls de lleguminoses on el compost leghemoglobina segresta l’oxigen.
Es dona la paradoxa que Trichodesmium, malgrat ser un cianobacteri fotosintètic oxigènic, i per tant produir oxigen i ser fixador de N2, no té heterocists, si bé no és l’únic gènere amb aquestes característiques (Bergman et al 1997). Enlloc dels heterocists, la fixació de nitrogen a Trichodesmium té lloc a unes cèl·lules relativament especialitzades, els diazòcits, que contenen la nitrogenasa però no tenen parets cel·lulars engruixides (Figura 5). Com veiem, la zona de diazòcits no té grànuls, és més clara, es tenyeix diferent de la resta i on es detecta per immunofluorescència la presència de la proteïna NifH de la nitrogenasa (Bergman et al 2013).

En els cianobacteris amb heterocists, la fixació de nitrogen i la fotosíntesi es produeixen simultàniament, durant el dia amb llum, perquè els dos processos se separen en l’espai utilitzant els heterocists per protegir l’enzim nitrogenasa sensible de l’oxigen. L’energia que cal als heterocists és aportada per les altres cèl·lules que realitzen la fotosíntesi. Alguns altres cianobacteris, els menys, fan la separació en el temps fent fotosíntesi durant el dia i fixant N2 per la nit.
En canvi, les zones de diazòcits de Trichodesmium no tenen la protecció estructural dels heterocists i la quasi inexistent separació temporal entre els dos processos és peculiar i única entre els diazòtrofs. Així, la nitrogenasa dels diazòcits és activa durant les hores de llum, però sobretot amb un màxim al migdia, coincidint amb una baixada en la captació de CO2 i la producció d’O2, i un augment dels mecanismes segrestadors d’O2. Aquests serien d’una banda l’esmentada protecció respiratòria —amb augment de l’activitat citocrom c oxidasa—, i a més l’anomenada reacció de Mehler, també observada als cloroplasts de plantes, que és la reducció de l’O2 a H2O2 per electrons del fotosistema I, on aquest és acoblat reversiblement al fotosistema II. Tot seguit el H2O2 és reduït per algun dels sistemes antioxidants propis. Per tant, sorprenentment la fixació de N2 depèn de l’activitat dels fotosistemes a Trichodesmium (Bergman et al 2013).
———————
ELS AGREGATS DE TRICHODESMIUM
Aquest cianobacteri es troba als oceans o bé en forma de filaments multicel·lulars dispersos, o bé en forma d’agregats que comprenen centenars de filaments, amb l’aspecte final comentat de flocs o colònies (Figures 3 i 5a). L’agregació de filaments passa sobretot durant el dia amb llum, després de la fase exponencial de creixement, i també en situacions d’estrès per canvis en les condicions ambientals, com la mancança de fosfat o ferro. Els agregats, com a flocs que són, permeten una ràpida migració vertical cap al fons, sobretot per tal de capturar fosfat. A la superfície assimilen i acumulen C i N i un cop al fons, uns 100-200 m, capturen el fòsfor que manca a la superfície (Rodríguez 2017). Els agregats alhora creen microambients subòxics que redueixen la fixació de N2 i de CO2, però també faciliten la captació de ferro que alhora permet recuperar la fixació de N2 simultània amb la fotosíntesi (Pfreundt et al 2023).
Recentment s’ha vist que la formació dels agregats a partir dels filaments individuals pot ser molt ràpida i deguda a canvis bruscos en la llum com pot ser el pas de núvols (Figura 6), i que les agregacions són degudes a canvis en la motilitat dels filaments individuals, per tal de disposar-se en contacte i solapant-se uns amb els altres, el que es coneix com a tigmotàxia o orientació per contacte (Figura 5a). Quan dos filaments es toquen, rellisca un damunt de l’altre, i en direcció contrària un de l’altre per tal d’anar augmentant la mida de l’agregat, i quant més freqüents són les reversions, més dens és el floc (Pfreundt et al 2023).
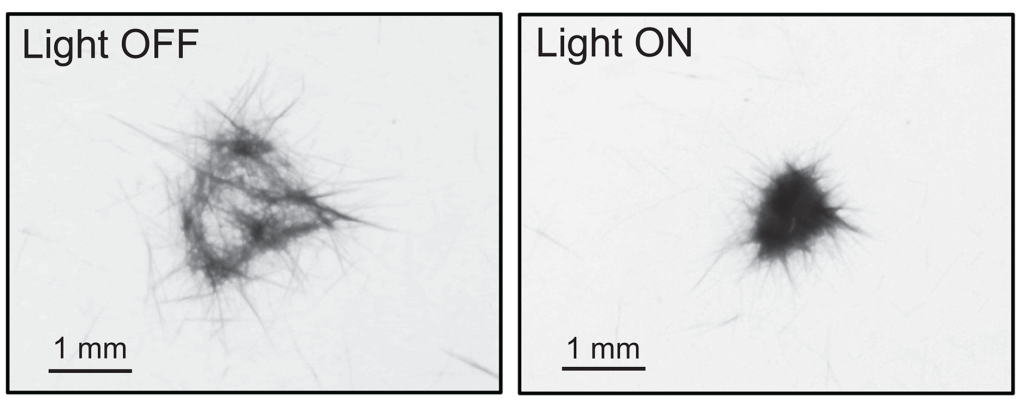
———————
NO NOMÉS EL NITROGEN, TAMBÉ EL FERRO I EL CARBONI
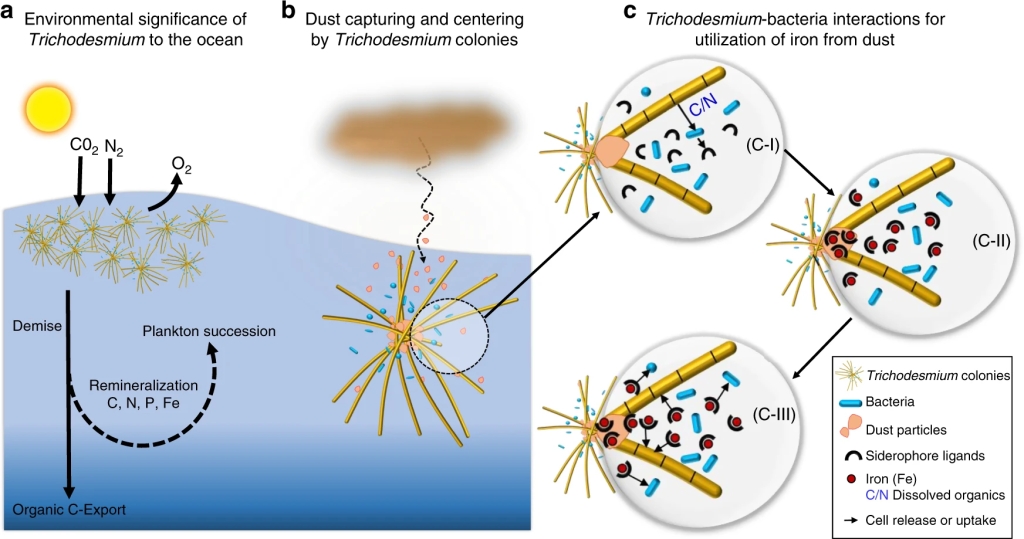
La biodisponibilitat del ferro (Fe) limita el creixement del fitoplàncton a mar obert dels vastos oceans. La pols transportada per l’atmosfera des dels deserts a la superfície dels oceans és rica en Fe però aquest és poc biodisponible perquè és poc soluble en aigua de mar i la pols s’enfonsa ràpidament per sota de la zona fòtica on és el fitoplàncton.
L’excepció es Trichodesmium, perquè les seves colònies o flocs capturen les partícules d’aquesta pols i simbiòticament amb altres bacteris associats promouen la dissolució de la pols i la captació del Fe mitjançant sideròfors (Figura 7) (Basu et al 2019). En quant a la contribució de la pols del Sàhara a l’oceà Atlàntic s’ha demostrat la relació amb la proliferació de Trichodesmium al voltant de les Canàries (Figura 8) (Ramos et al 2005).

I a més a més, el cianobacteri Trichodesmium contribueix directament en l’exportació i segrest de carboni al llit marí. Fins ara se sabia que aquests microorganismes reciclaven el CO₂ captat de l’atmosfera mitjançant la fotosíntesi, però no que també se l’enduien amb ells a les profunditats quan moren i s’enfonsen, com sí que ho fa la resta del fitoplàncton, és a dir, els eucariotes. Això s’anomena la bomba biològica de carboni, i d’aquesta manera s’emmagatzema al llit marí aproximadament el doble de carboni del que es troba actualment a l’atmosfera. Fins ara això s’atribuïa quasi exclusivament al fitoplàncton eucariota, i els models biogeoquímics globals, és a dir, les eines que s’utilitzen per fer prediccions sobre l’evolució i els fluxos de carboni al planeta, no tenen en compte la contribució directa dels diazòtrofs com Trichodesmium en aquest procés (Cornejo 2022, Bonnet 2022).
———————
CONCLUSIÓ
Per concloure, es pot dir que el cianobacteri Trichodesmium és un dels organismes més abundants dels ambients marins, és part substancial del fitoplàncton i per tant molt important productor primari. És el fixador de nitrogen més rellevant al mar, i un dels més importants per als cicles biogeoquímics globals de nitrogen, carboni, fòsfor i ferro. I a més, té una variable i complexa estructura d’agrupaments, i és encara poc conegut del punt de vista de funcionament del seu metabolisme i de regulació del seu gran genoma, malgrat ser procariota.
———————
BIBLIOGRAFIA
Basu S et al (2019) Colonies of marine cyanobacteria Trichodesmium interact with associated bacteria to acquire iron from dust. Comm Biol 2, 28
Bergman B et al (1997) N2 fixation by non-heterocystous cyanobacteria. FEMS Microbiol Rev 19, 139–185
Bergman B et al (2013) Trichodesmium –a widespread marine cyanobacterium with unusual nitrogen fixation properties. FEMS Microbiol Rev 37, 286–302
Bonnet S et al (2022) Diazotrophs are overlooked contributors to carbon and nitrogen export to the deep ocean. The ISME Journal, 1-12
Capone DG et al (1997) Trichodesmium, a Globally Significant Marine Cyanobacterium. Science 276, 1221-1229
Cornejo FM (2022) Els bacteris marins diazòtrofs, petits grans aliats contra el canvi climàtic. Institut de Ciències del Mar ICM-CSIC, 18 oct. 2022
Huisman et al (2018) Cyanobacterial blooms. Nature Rev Microbiol 16, 471-483
Le Page M (2023) Ocean-fertilising bacteria work together to adapt to light levels. New Scientist, 25 May 2023
MicrobeWiki (2010) Trichodesmium. A Microbial Biorealm page, Kenyon College, 6 Aug 2010
Partensky F et al (1999) Prochlorococcus, a marine photosynthetic prokaryote of global significance. Microbiol Mol Biol Rev 63, 106-127
Pfreundt U et al (2023) Controlled motility in the cyanobacterium Trichodesmium regulates aggregate architecture. Science 380,830-835
Ramos AG et al (2005) Bloom of the marine diazotrophic cyanobacterium Trichodesmium erythraeum in the Northwest African Upwelling. Marine Ecol Progress Series 301, 303-305
Rodríguez F (2017) Más respuestas sobre Trichodesmium. Blog Fitopasión, 1 agosto 2017
Wikipedia contributors (2023, May 28). Cyanobacteria. Wikipedia, The Free Encyclopedia
Wikipedia contributors (2022, July 18). Trichodesmium. Wikipedia, The Free Encyclopedia
WHOI, Woods Hole Oceanographic Institution (2023) The many faces of Trichodesmium
Microbiota de la hibernació: els bacteris treballen mentre l’animal dorm
13 abril 2023
Click here for the English version: Hibernation microbiota
HIBERNACIÓ
La hibernació és un estat de mínima activitat i alentiment del metabolisme que duen a terme alguns animals —bàsicament els mamífers—, usualment durant l’hivern, encara que n’hi ha alguns que fan “estivació”. Quan hibernen, els baixa la temperatura, les freqüències cardíaca i de respiració, i el metabolisme en general. Aquest estat corporal fisiològic es coneix com a torpor.
Per exemple, els esquirols de terra (Figura 1 ) o les marmotes hibernen uns 6 mesos, de la tardor a la primavera, respirant un cop per minut, amb uns 5 batecs cardíacs per minut i la temperatura els baixa a només 5-10oC. Aquest estat de torpor no és constant, sinó que cada 10-12 dies hi ha unes fases d’interrupció, on reviuen una mica durant unes 12 hores, els puja la temperatura (Figura 2), tremolen una mica com per escalfar-se i el metabolisme s’activa (Carey et al. 2003), però ni mengen ni beuen ni defequen (Wilke 2020).

Figura 1. Un esquirol de terra (Ictidomys tridecemlineatus) hibernant. Imatge de R. Streiffer, treta de Garcia de Jesús (2022).
———————
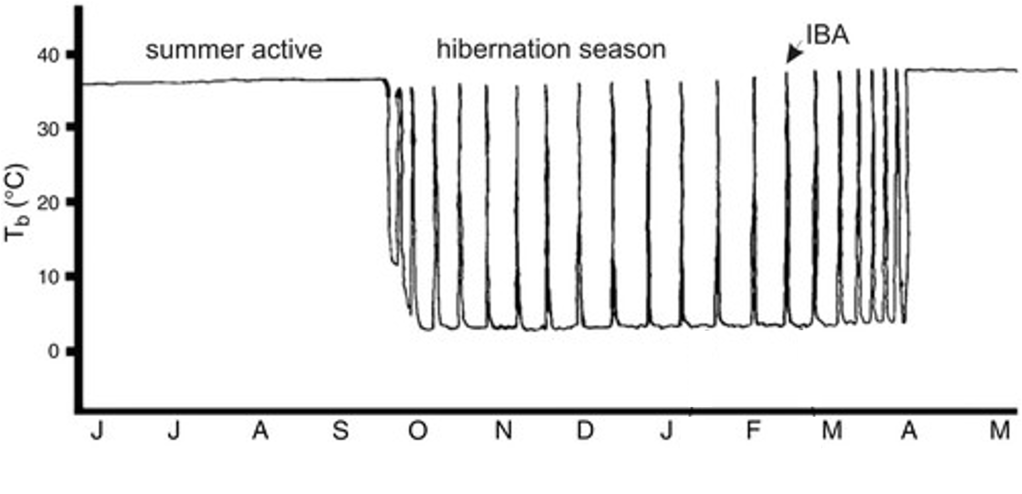
Figura 2. Temperatura corporal (Tb) d’un esquirol de terra al llarg de l’any, de juny a maig. Al període d’hibernació s’observen els cicles de llargues fases de torpor (10-12 dies) amb les petites fases d’interrupció (IBA, 12 hores) (Adaptat de Carey et al. 2003).
La hibernació serveix per mantenir i estalviar l’energia corporal quan no hi ha prou menjar disponible. Per això, abans d’hibernar i en general tots els mesos més càlids, aquests animals mengen molt, acumulant suficient reserves energètiques per al període hivernal. Tots ells hibernen en caus o coves, resguardats una mica del fred i altres inclemències exteriors.
El període d’hibernació és molt variable, des de poques setmanes a mesos, i pot ser obligat o facultatiu. També es distingeixen diferents nivells de hibernació, des d’hivernants profunds com molts rosegadors, el lèmur ratolí, l’eriçó i força marsupials, fins als hivernants més lleugers com els óssos. En aquests la temperatura corporal només els baixa uns 5oC i en canvi en alguns rosegadors baixa més de 30oC.
D’altra banda, els animals vertebrats ectotèrmics —de sang freda— com peixos, amfibis i rèptils, també baixen la seva activitat metabòlica i la temperatura corporal i entren en un estat de torpor, però no es considera hibernació perquè no ho fan de forma activa sinó que és en funció de l’ambient extern.
———————
METABOLISME DE LA HIBERNACIÓ
La hibernació és una estratègia dels mamífers que utilitza la plasticitat metabòlica per reduir les demandes d’energia i permetre dejunis de llarg termini. Per permetre aquests llargs períodes sense menjar, molts d’aquests animals mengen molt més abans d’hibernar, i acumulen greix corporal. Els óssos bruns per exemple arriben a doblar els dipòsits de greix i van consumint els lípids guardats al llarg de la hibernació. Encara que aquests óssos esdevenen obesos estacionalment, es mantenen metabòlicament sans, la qual cosa contrasta amb la forta relació entre obesitat i resistència a la insulina i altres problemes metabòlics que s’observen en els humans (Sommer et al. 2016).
El dejuni mitiga l’escassetat d’aliments hivernal però s’elimina el nitrogen de la dieta, amb la qual cosa posa en perill l’equilibri corporal de proteïna (Regan 2022). L’atròfia muscular deguda al dejú —o a la inactivitat— allibera compostos de nitrogen com l’amoni, que poden ser tòxics, i el cos n’ha d’eliminar l’excés, normalment en forma d’urea, mitjançant l’orina. Tanmateix, els animals hivernants com els molt estudiats esquirols de terra mantenen o perden molt poca massa muscular al llarg de l’hivern, i fins i tot a la fase final de la hibernació la taxa de síntesi de proteïnes augmenta fins a nivells semblants a quan estaran actius. Després veurem el paper de la microbiota en aquesta recuperació del nitrogen.
El coneixement de com aquests animals mantenen la massa muscular pot ajudar a trobar remei en el cas de les persones amb pèrdua muscular degut a malnutrició, sedentarisme forçat o malalties de desgast muscular (García de Jesús 2022).
———————
LA MICROBIOTA INTESTINAL DELS HIBERNANTS
Un dels mamífers hivernants més coneguts i estudiats és l’ós bru (Ursus arctos). Sommer et al. (2016) van fer un estudi amb 16 óssos bruns euroasiàtics en llibertat als boscos del centre i nord de Suècia, prenent-los mostres fecals i de sang per a l’estudi metabòlic, tant durant la hibernació (febrer-març) com al període actiu (juny). La microbiota fecal fou analitzada per metagenòmica, extraient el DNA genòmic, amplificant la regió V2-V3 del gen per al 16S rRNA, seqüenciant-la per 454 piroseqüenciació i analitzant-ho amb el programa MacQIIME per obtenir-ne la identificació. Els resultats observats van ser una clara diferència entre hivern i estiu, demostrable amb una anàlisi PCA (Figura 3, esquerra). També veieren una major diversitat de microbiota a l’estiu, 4 cops respecte la d’hivern, la qual era més homogènia que la d’estiu (resultats no mostrats). La heterogeneïtat de l’estiu pot estar relacionada amb una dieta més variada. La menor diversitat hivernal va lligada a una reducció sobretot de Firmicutes i d’Actinobacteria, i en canvi hi ha un augment de Bacteroidetes (Figura 3, dreta).
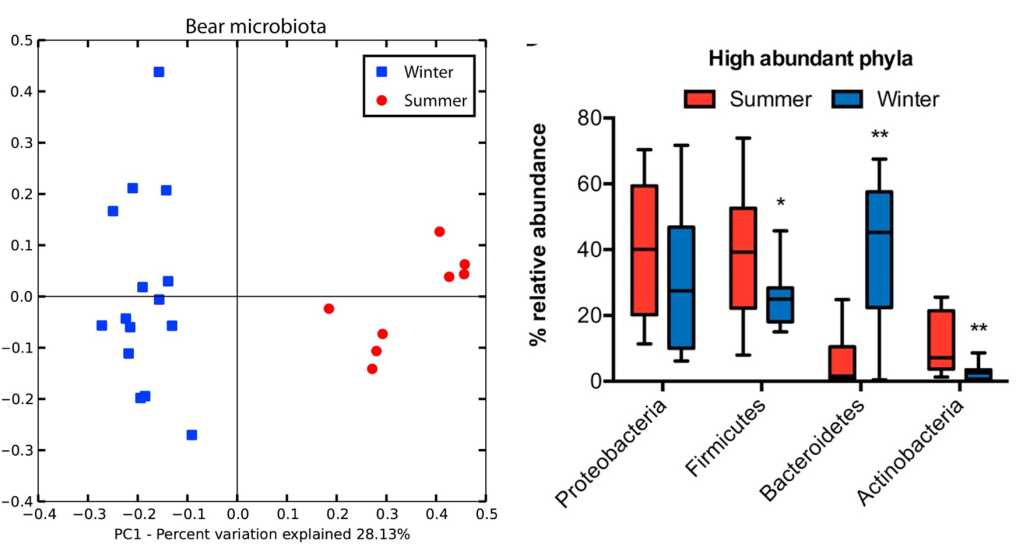
Figura 3. Microbiota fecal de l’ós bru comparada a l’hivern (blau) i l’estiu (vermell). Esquerra: PCA (anàlisi de components principals); dreta: abundància relativa dels fílums més abundats (Sommer et al. 2016).
L’augment de Bacteroidetes —sobretot Bacteroides fragilis— durant la hibernació pot explicar-se per llur capacitat de degradar glicans de l’hoste en absència de polisacàrids de la dieta i també perquè els Bacteroidetes poden metabolitzar proteïnes i greixos de l’epiteli intestinal. Els Firmicutes com Streptococcus probablement disminueixen perquè requereixen més fibra, la de la dieta (Sommer et al. 2016).
S’ha vist que la hibernació dels óssos bruns també afecta al metabolisme, sobretot lipídic. I a més, en fer transplantaments de la microbiota dels óssos hivernants o dels actius al juny a ratolins sense microbiota comporta que els ratolins adquireixen els trets metabòlics estacionals corresponents respectivament d’hivern o estiu (Sommer et al. 2016).
Cal senyalar que les temperatures corporals més baixes durant la hibernació són molt per sota les temperatures òptimes de la majoria de microbis intestinals, però com he comentat abans, el torpor és interromput periòdicament per unes curtes fases de pujada tèrmica que permeten —a banda d’activar el metabolisme de l’animal— incrementar el metabolisme bacterià, amb la conseqüent degradació dels substrats presents al lumen intestinal (Carey et al. 2013).
Uns dels animals més estudiats en relació a la hibernació i llur microbiota són els esquirols de terra, i en concret l’anomenat suslic (de l’original suslik en rus) o esquirol de terra de 13 bandes, Ictidomys tridecemlineatus (abans Spermophilus tridecemlineatus) (Figura 4). Tenen una coloració llampant, amb ratlles i taques al pelatge dorsal que fan que sigui molt fàcil distingir-los d’altres espècies. Aquests esquirols de terra, junt amb els més coneguts arborícoles, les marmotes, els esquirols voladors i els gossets de les praderies, constitueixen la família d’esciúrids, dins l’ordre Rodentia, els rosegadors.

Figura 4. EL suslic o esquirol de terra de 13 bandes (Ictidomys tridecemlineatus). Imatge de Cheryl Gorske, treta de Pinterest.
L’efecte del cicle anual d’hibernació en la microbiota intestinal del suslic ha estat estudiat (Carey et al. 2013) per metagenòmica de forma semblant a la comentada per als óssos bruns, seqüenciant els gens del 16 S rRNA a partir de mostres del cec de I. tridecemlineatus.
En aquest estudi els grups bacterians més abundants trobats, i que tenien més variació en l’estat d’hibernació respecte quan els animals eren actius foren Firmicutes, Bacteroidetes i Verrucomicrobia (com Akkermansia muciniphila, coneguda com a beneficiosa a la microbiota humana). Com veiem (Figura 5), en l’estació activa hi ha més Firmicutes mentre que amb la hibernació augmenten els altres dos grups. Com he comentat per als óssos, els Firmicutes prefereixen una dieta rica en polisacàrids mentre que els Bacteroidetes —i els Verrucomicrobia en aquest cas— consumeixen mucines produïdes per l’intestí. També hi ha menor diversitat de bacteris en hivernant. Les diferències de microbiota entre estació activa i hibernació són estadísticament significatives, molt més que les observades per l’edat, la dieta anterior a l’hibernació, i altres condicions. Tot plegat, la microbiota d’aquests suslics es reestructura cada any reflectint les diferències en les preferències dels microbis en quant als substrats de la dieta o de l’hoste i de les capacitats de supervivència dels diferents tàxons en l’ambient alterat de l’intestí en hibernació (Carey et al. 2013).
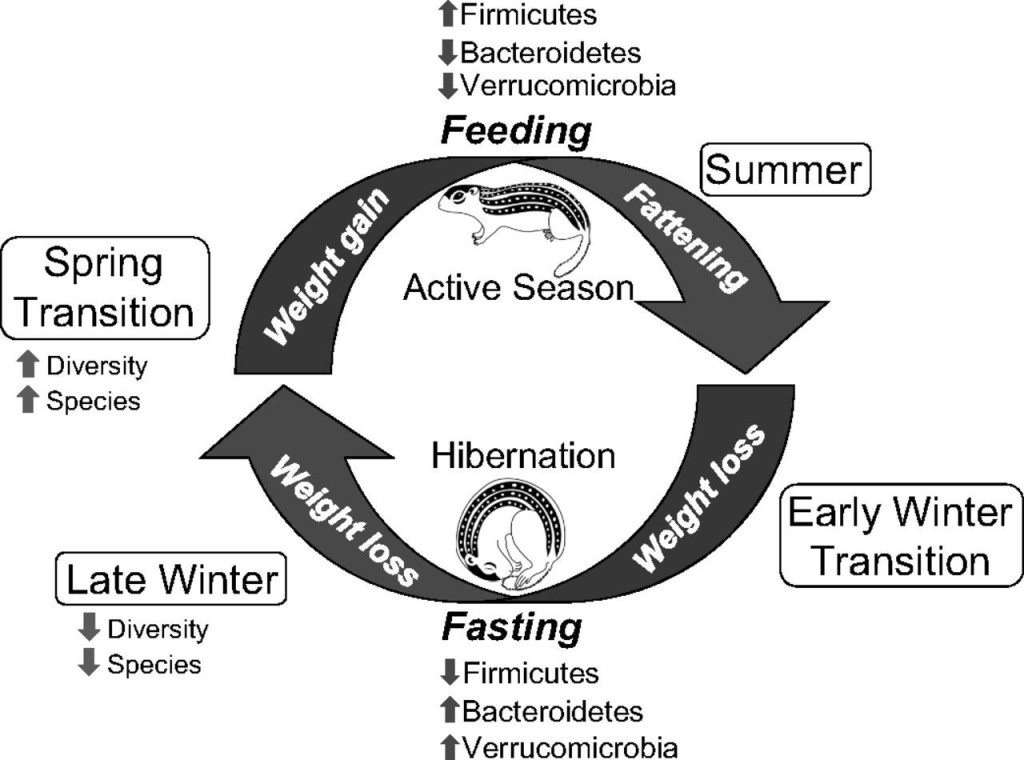
Figura 5. Esquema il·lustratiu dels principals canvis a la microbiota de l’esquirol de terra al llarg del cicle anual d’hibernació (Treta de Carey et al. 2013)
———————
LA MICROBIOTA DE LA HIBERNACIÓ PERMET LA RECUPERACIÓ DEL NITROGEN
Com hem vist abans, amb la hibernació manca el nitrogen de la dieta, i el mínim metabolisme de manteniment comporta un consum de les reserves de proteïnes —que pot portar a l’atròfia muscular—, i amb aquest consum s’alliberen compostos de nitrogen com l’amoni que és tòxic i el cos l’elimina en forma de urea per l’orina.
Però aquests animals no perden massa muscular durant l’hivern, i no excreten urea, ja que no orinen quan hibernen. Cóm s’explica ? Doncs la microbiota és la que permet la supervivència de l’animal durant la hibernació. Efectivament, s’ha vist que la microbiota dels comentats esquirols de terra de 13 bandes —Ictidomys tridecemlineatus— reciclen la urea produïda pel catabolisme de proteïnes, en aquest procés anomenat recuperació del nitrogen ureic (urea nitrogen salvage), on la ureasa microbiana té un paper clau.
De fet, aquest mecanisme ja era conegut als remugants, ja que la molt complexa microbiota del rumen inclou el reciclatge del nitrogen proteic dels mateixos microorganismes a través de la urea, i fins i tot aquest compost s’utilitza com a alternativa nitrogenada a la dieta dels remugants estabulats, donada la gran capacitat ureàsica de la rica i diversa microbiota remugant (Patra et al. 2018).
Però als animals monogàstrics com aquests esquirols no es coneixia aquesta capacitat de recuperació del N ureic, demostrada recentment per Regan et al. (2022). La urea resultant del catabolisme de les proteïnes de l’animal (Figura 6) és transformada per la ureasa dels microbis del cec intestinal en CO2 i amoni, i aquest és aprofitat per altres microbis per generar aminoàcids que són finalment transportats al fetge per sintetitzar proteïnes per als diferents òrgans.
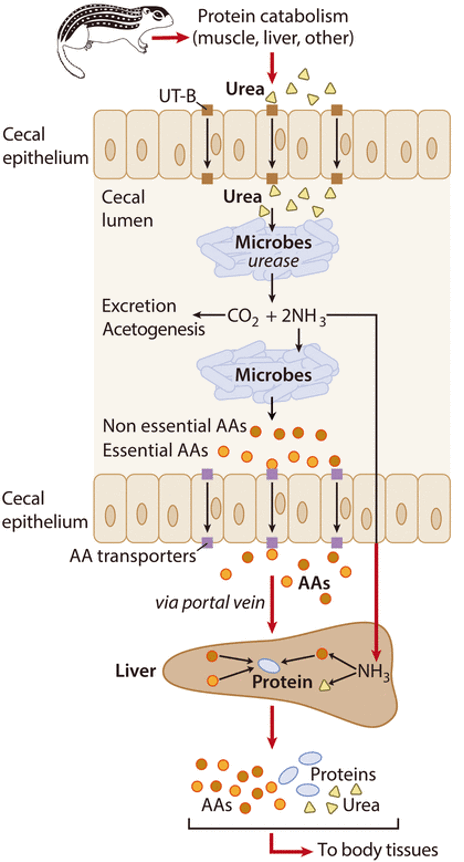
Figura 6. Mecanisme proposat de recuperació de N de la urea per la microbiota del cec del budell gruixut durant la hibernació del suslic Ictidomys tridecemlineatus (Figura treta de Regan et al. 2022).
Regan et al. (2022) també han vist que la recuperació del N ureic és més gran al final de la hibernació, just abans que l’esquirol es desperti i entri a l’estació activa, on li caldrà que els músculs s’hagin ben recuperat del torpor. Aquest augment de recirculació de N es reflecteix en la major abundància de transportadors d’urea i dels gens de la ureasa en aquest període (Figura 7). Els gens de la ureasa són 7: 1 transportador, 2 estructurals i 4 accessoris.
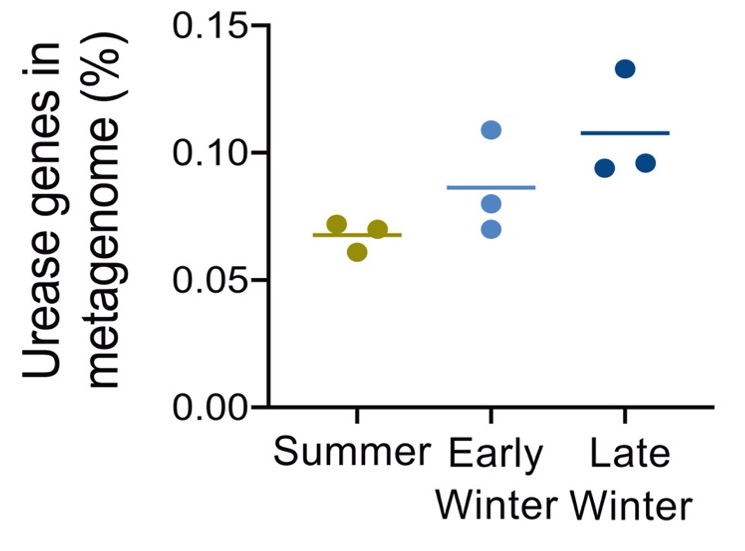
Figura 7. Proporció dels gens d’ureasa al metagenoma bacterià del budell de Ictidomys tridecemlineatus, a l’estiu, inici d’hivern i hivern tardà (Regan et al. 2022)
En analitzar la metagenòmica dels gens de la ureasa també s’ha vist que els tàxons bacterians més abundants són diferents en funció de quin d’aquests 3 períodes (Figura 8). Com veiem, el gènere Alistipes (un Bacteroidetes) és el que té més proporció de gens de la ureasa durant la hibernació, on també és el gènere més abundant, amb poblacions a l’hivern tardà sis cop superiors a les de l’estiu (Regan et al. 2022).
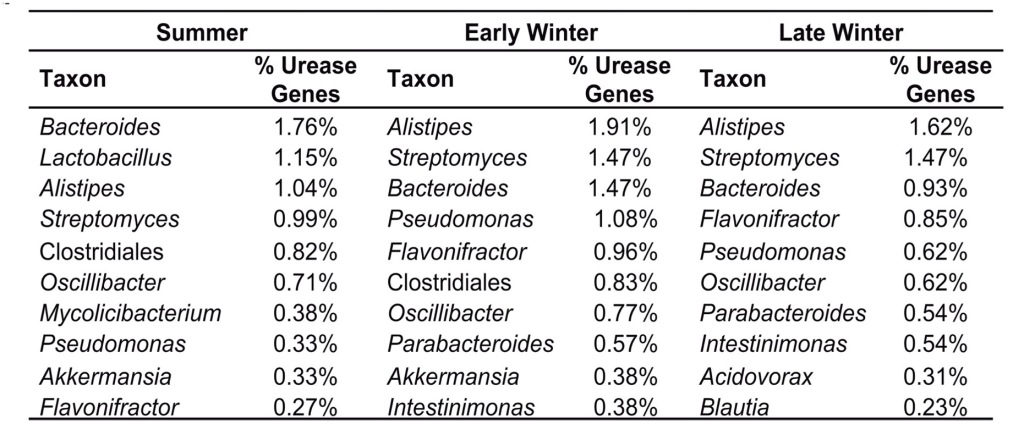
Figura 8. Els 10 tàxons bacterians més abundants en quant als gens d’ureasa a les seqüències del metagenoma bacterià del budell de Ictidomys tridecemlineatus, a l’estiu, inici d’hivern i hivern tardà (Regan et al. 2022)
A més a més, la recuperació del nitrogen de la urea pot facilitar l’estalvi d’aigua als esquirols hivernants desviant urea dels ronyons, amb la qual cosa cal menys aigua per a la producció d’orina, com també passa als camells quan els falta aigua (Mousa et al. 1983).
———————
I MÉS ENLLÀ DE LA HIBERNACIÓ
Aquest mecanisme de recuperació del nitrogen per la microbiota té implicacions que van més enllà de la hibernació. Per exemple, l’atròfia muscular afecta milions d’humans per causa de dietes limitades en nitrogen o també de sarcopènia a les persones d’edat avançada. Una millor comprensió dels mecanismes de com la microbiota de la hibernació mitiga els efectes de la limitació de nitrogen podria proporcionar estratègies per a la preservació dels músculs als humans (Regan et al. 2022).
D’altra banda, com hem vist, els óssos bruns —i altres animals— acumulen molt de greix abans d’hibernar i en canvi es mantenen metabòlicament sans. Entendre els mecanismes fisiològics subjacents i la possible relació amb la microbiota podria donar pistes per a noves teràpies de l’obesitat als humans (Sommer 2016).
I des d’un punt de vista més general, està clar que la coevolució dels mamífers —i altres animals— amb els microbis intestinals ha produït unes relacions ben complexes que donen beneficis a les dues parts simbionts. Els microbis modelen la biologia de llurs hostes de múltiples maneres, augmenten la resistència a la colonització per patògens, influeixen en la funció i estructura gastrointestinal, dirigeixen el desenvolupament del sistema immunitari, i augmenten la captació d’energia de la dieta. Al seu torn, els hostes animals proporcionen un ambient ric en nutrients que permet el desenvolupament de comunitats microbianes ben variades (Carey et al. 2013).
———————
BIBLIOGRAFIA
Carey HV, Andrews MT, Martin SL (2003) Mammalian Hibernation: Cellular and Molecular Responses to Depressed Metabolism and Low Temperature. Physiol Rev 83: 1153-1181.
Carey HV, Walters WA, Rob Knight R (2013) Seasonal restructuring of the ground squirrel gut microbiota over the annual hibernation cycle. Amer J Physiol-Reg It Comp Physiol 304, R33-R42
Garcia de Jesús E (2022) Gut microbes help some squirrels stay strong during hibernation. ScienceNews 27 Jan 2022.
Hibernation (2023, April 4). Wikipedia
Mousa HM, Ali KE, Hume ID (1983) Effects of water deprivation on urea metabolism in camels, desert sheep and desert goats fed dry desert grass. Comp Biochem Physiol A Comp Physiol 74:715-20
Patra AK, Aschenbach JR (2018) Ureases in the gastrointestinal tracts of ruminant and monogastric animals and their implication in urea-N/ammonia metabolism: A review. J Adv Res 13, 39-50.
Regan MD et al (2022) Nitrogen recycling via gut symbionts increases in ground squirrels over the hibernation season. Science 375, 6579, 460-463
Sommer F et al. (2016) The Gut Microbiota Modulates Energy Metabolism in the Hibernating Brown Bear Ursus arctos. Cell Reports 14, 1655-1661.
Thirteen-lined_ground_squirrel (2023, April 4) Wikipedia
Wilke C (2020) These Arctic squirrels recycle bits of their own bodies to survive winter. ScienceNews 16 Dec 2020.
Carn alternativa: menjar proteïna microbiana i altres
10 desembre 2022
Click here for the English version: Alternative meat: eating microbial protein and others
PROBLEMES DE LA PRODUCCIÓ DE PROTEÏNA ANIMAL
La majoria de proteïna que els humans consumim és la càrnica d’origen animal produïda per la ramaderia industrial, ja siguin aus o mamífers, i d’aquests sobretot els remugants com les vaques, bous i vedells, dels quals la producció a nivell mundial s’ha doblat en els darrers 50 anys. Els sistemes de granges industrials, tant les intensives com les extensives, tenen conseqüències ambientals molt negatives. Com veiem esquematitzat a la Figura 1, els principals perjudicis són:
La superfície de terreny ocupada per la ramaderia cada cop és més gran. Comptant el terreny de pastures i els conreus de vegetals per alimentar els animals —cereals i soja sobretot—, ja s’arriba quasi al 30% de la superfície de terra, molt més que la dedicada als conreus de consum humà, un 13%. En el cas de la soja per exemple, 3/4 de la seva producció es dedica a pinsos, i una part important prové de regions de Brasil que prèviament eren selva o sabana (Hooper 2022).
L’aigua dolça utilitzada per a la fabricació de qualsevol producte s’anomena petjada hídrica (Hidrofílic 2017). Aquesta en el cas de la ramaderia, que inclou el conreu vegetal de pinsos, és molt més gran que qualsevol altre conreu agrícola: es necessiten 15000 L d’aigua per a cada kg de carn bovina, 9000 L per kg carn d’ovella, 6000 L per kg carn de porc, mentre que només en calen 300 L per a kg de verdures o 900 L per kg de fruites o uns 4000 L per kg de llegums, encara menys que per als animals (Mekonnen & Hoekstra 2010). Com veiem (Figura 1), es calcula que als USA un 30% de la petjada hídrica total és deguda a la ramaderia industrial.
Un terç de les emissions globals de gasos amb efecte d’hivernacle (GEH) són causades pel sistema alimentari, i dins d’aquest la ramaderia n’és el principal contribuent, sobretot pel gas metà expel·lit pels remugants, resultat del metabolisme dels arqueus metanògens, pas final de la fermentació del rumen. Com a GEH, les emissions de metà del boví són les que causen més impacte ambiental amb molta diferència, essent d’uns 100 kg de metà per cada 100 g proteïna produïda (Poore & Nemecek 2018).
Finalment, cal tenir en compte les repercussions de degradació i erosió del terreny que suposa la ramaderia industrial, així com l’acidificació del sòl, les contaminacions per antibiòtics i l’eutrofització per l’ús excessiu dels fertilitzants (Humpenöder et al. 2022).

Figura 1. Impacte ambiental de la indústria ramadera. Imatge treta de Ecopeanut.com.
Es calcula que pel 2050 la població humana mundial serà de quasi 10000 milions (ara al 2022 som 7800 milions), per a les quals caldran unes 400 milions de tones de carn i 800 de productes lactis per any, quantitat que no es podrà aconseguir per la baixa eficiència de la proteïna vegetal dels pinsos en proteïna animal, que és de 6 kg de vegetal per a 1 kg animal (Ritala 2017).
Tot plegat, alguns activistes ambientals ben inquiets com George Monbiot creuen que les explotacions agrícoles i ramaderes comporten una destrucció, explotació i sense sentit econòmic que estan matant el planeta. Tanmateix, també creu que hi ha l’esperança d’un món més sostenible i saludable que passaria per un consum de microbis enlloc d’animals (Hooper 2022).
Per tant, està clar que aquesta situació a mig termini no és sostenible ambientalment i cal trobar-hi alternatives per substituir gran part de la proteïna animal per altres fonts, com les microbianes i altres.
———-
L’ALTERNATIVA VEGETAL
L’alternativa de proteïna vegetal és molt coneguda i forma part de la nostra dieta habitual (Figura 2). Portant-ho a l’extrem, els vegetarians basen la seva dieta només en vegetals i exclouen els aliments càrnics. A la Índia són 1/3 de la població, però a la resta del món els vegetarians són minoritaris, un 5% a Europa. Els motius dels vegetarians —i els vegans, que són més estrictes— són molt diversos, com ètics (sensibilitat animal), de salut, religiosos, polítics, de moda, estètics, econòmics, però també cada cop més hi ha els motius esmentats de conscienciació ambiental i de sostenibilitat.

Figura 2. Dieta vegetariana. Imatge treta de Salud Blogs Mapfre.
Les fonts de proteïna vegetal són valuoses nutritivament, ja que contenen fibra —quasi inexistent a les carns— i antioxidants, però el seu contingut en proteïna sempre és més baix que la de la carn, a la qual n’és un 45% de l’extracte sec. Els aliments vegetals amb més proteïna són la soja (un 35%) i els llegums com pèsols, cigrons o fesols (un 20-25%). En canvi el blat, arròs i altres cereals o les patates només contenen un 10% de proteïna. La llet conté un 25% i els ous un 40% de l’extracte sec.
L’inconvenient principal de la proteïna vegetal respecte l’animal, a més del menor contingut total de proteïna, és la menor qualitat nutricional en quant a aminoàcids essencials i menor digestibilitat, amb la qual cosa cal incrementar un 10-20% de proteïna si només es consumeixen aliments vegetals (Petrusán et al 2016). Un altre inconvenient és l’ambiental, en part semblant a l’animal, per les necessitats de grans extensions de terreny i de molta aigua (Ritala et al. 2017).
———-
MENJAR INSECTES ?
Una altra alternativa és el consum de proteïna d’insectes, o sigui l’entomofàgia. El contingut en proteïna de l’extracte sec dels insectes és molt alt, entre un 35% dels tèrmits i el 60% dels grills i llagostes, i la majoria dels insectes comestibles tenen continguts alts dels aminoàcids essencials, i de fibra, minerals i vitamines. Les “granges” d’insectes són molt adients amb la sostenibilitat i el medi ambient, ja que no requereixen terreny, els cal poca aigua, emeten molt pocs gasos d’EH, i són avantatjosos econòmicament. Per tant, tenen un molt bon potencial com a menjar de qualitat (Lange & Nakamura 2021). Tanmateix, l’acceptació del consumidor és un gran obstacle, sobretot als països occidentals. En canvi, són habituals a l’Àfrica subsahariana, al sud-est asiàtic, Austràlia i alguns països iberoamericans com Mèxic, on els “escamoles” són larves de la formiga Liometopum apiculatum molt populars des de temps prehispànics (Figura 3).

Figura 3. Plat d’escamoles mexicans. Imatge treta de Lideresmexicanos.com.
Quan els insectes es produeixen industrialment, cal tenir en compte i controlar les possibles fonts de riscos de seguretat alimentària, com són els al·lèrgens, els microorganismes patògens que poden ser transmesos via insectes, o les micotoxines de fongs que contaminin els insectes (Lange & Nakamura 2021).
Actualment, la majoria d’inversions en la producció d’insectes comestibles són en el menjar per a animals. Se n’estan produint en forma de pols de proteïna per a animals domèstics, en aqüicultura i s’està començant a introduir com a complement dels pinsos del bestiar. A més els excrements dels insectes en la fase productiva poden ser utilitzats com a fertilitzant (Godwin 2021).
———-
CARN CULTIVADA O SINTÈTICA
També anomenada carn “in vitro” o carn “neta” o “carn de laboratori”, consisteix en fer créixer teixit muscular animal en cultius de laboratori a partir de cèl·lules mare. Amb aquest mètode més ràpid i eficient que l’obtenció de carn tradicional no cal ni sacrificar animals ni hi han tots els inconvenients comentats de la ramaderia.
Per aconseguir carn cultivada cal un seguit de requeriments resumits en aquests passos que han de funcionar bé tant del punt de vista biològic com comercial:
- Obtenir mostres del múscul esquelètic de l’animal adequat
- Separar-ne les cèl·lules mare dels altres components musculars i a vegades altres tipus cel·lulars
- Induir el creixement i proliferació dels mioblasts en les condicions físico-químiques i medi adequat, amb factors de creixement
- Induir que els mioblasts formin els miotubs multinucleats, en una estructura marc o bastida, com el col·lagen
- Aconseguir el creixement continuat de nous mioblasts i la diferenciació dels miotubs en fibres musculars
- Assegurar el creixement continuat al llarg de l’augment d’escala, introduint altres components com els adipòcits, amb els lípids que aporten palatabilitat
- Processar el producte resultant afegint-hi greixos, aromes i altres compostos, i modelar-ne l’aspecte físic, tot plegat per tal de mimetitzar els productes càrnics convencionals, la qual cosa és més fàcil amb productes processats, com la carn picada o el bacon (Figura 4) (Kadim et al. 2015).
La carn cultivada pot ser igual de bona i nutritiva que la convencional d’animals de granges, a més dels avantatges d’un dràstic menor efecte sobre el medi ambient i sobre l’animal en qüestió. A més, el rendiment és clarament major, ja que només amb una mostra de teixit es pot arribar a produir la mateixa quantitat de carn que amb 80 vaques (Bingham 2020).
Malgrat que els resultats preliminars fins ara són molt esperançadors, aquesta tecnologia encara no està prou desenvolupada per a la producció a gran escala, sobretot en quant als medis de cultiu, i l’acceptació i confiança per part del consumidor encara són molt minses (Kadim et al. 2015).

Figura 4. Carns “cultivades”, fetes amb cultius de cèl·lules animals, simulant un filet de vedella (esquerra) o una carn processada (dreta). Imatges tretes de Bingham (2020).
De manera semblant, també s’està desenvolupant la producció de filets de peix i de carn de marisc amb cultius cel·lulars, és el que se’n diu aqüicultura cel·lular. La substitució progressiva de peix capturat pel “peix cultivat” reduiria significativament la sobrepesca, s’eliminaria la pesca il·legal i la destrucció dels ecosistemes marins, i aquests aliments no tindrien possibles patògens o contaminants habituals com el metil-mercuri o les partícules de plàstic.
Aquests productes de peix i marisc cultivats tenen també les qualitats organolèptiques que els productes marins salvatges o de piscifactoria però amb l’avantatge de ser més sostenibles, segurs i saludables. Algunes de les empreses que els estan desenvolupant ho fan amb tècniques semblants als cultius d’organoides o miniòrgans, que s’utilitzen des de fa uns 10 anys per a l’estudi i tractament de malalties i tumors. Els cultius es fan en estructures tridimensionals permetent que les cèl·lules formin una composició natural de greix i múscul equivalent a la de l’animal (VelSid 2022).
———-
PROTEÏNA MICROBIANA
També es coneix com a “proteïna unicel·lular” (Single Cell Protein, SCP) perquè en origen molts eren microbis unicel·lulars com la majoria de bacteris —inclosos els cianobacteris—, els llevats i algunes microalgues (les unicel·lulars), però també s’inclouen alguns fongs filamentosos i algunes algues pluricel·lulars. Lògicament els microbis que més s’han estudiat en aquest sentit són els que contenen més proteïna. Tenim una bona revisió dels tipus, el procés d’obtenció i aplicacions al treball de Junaid et al. (2020).
Taula 1. Productes de “proteïna unicel·lular” (SCP), tots amb mínim 45% proteïna dins extracte sec. Adaptat de Ritala et al. (2017).
| Microorganisme | Tipus | Ús | Substrats | Companyies (país) | Problemes |
| Methylophilus, Methylococcus | Bacteris metilòtrofs i metanòtrofs, proteobacteris | Aliment d’animals | Metanol, metà | ICI (UK) “Pruteen” anys 1970, Calista Inc. (UK) “FeedKind” a partir de biogàs | Alt contingut en RNA i DNA (>10%), cal processat |
| Azonexus, Comamonadaceae | Bacteris oxidadors d’H2, proteobacteris | En perspectiva, aliment humà o altres animals | H2, CO2, O2, N2 | Startups: Air Protein (USA), Solar Foods (FI), Deep Branch (UK) | En R&D |
| Arthrospira maxima, A. platensis | Abans “Spirulina”, bacteris: Cianobacteris (“microalgues”) | Suplement dietètic, aliment d’asteques i pobles del Txad | CO2, llum | BlueBio Tech (D), Cyanotech (Hawaii USA), FEBICO (Taiwan), Parry Nutraceuticals (India) | Possible contaminació amb toxines (microcistines) d’altres cianobacteris, i per metalls pesants |
| Aphanizomenon flos-aquae(AFA) | Bacteris: Cianobacteris | Suplement dietètic, efectes positius a salut | CO2, llum | Blue Green Foods (USA), E3Live (USA), Klamath Valley (USA) | Algunes soques tòxiques |
| Chlorella | Microalgues verdes: Chlorophyta | Suplement dietètic | CO2, llum | TerraVia (USA), Roquette Klötze (D), FEBICO (Taiwan), BlueBioTech (D) | Producció costosa: aigua carbonatada. Paret cel·lular indigerible |
| Saccharomyces cerevisiae | Fong unicel·lular (llevats), ascomicets | Extracte de llevat: suplement dietètic | Melasses, cereals hidrolitzats | Bega Cheese (AUS), Flint Hills Resources (USA) | Ocasional: migranyes per tiramina, digestions irregulars, intolerància en malalts de budell inflamat * |
| Torula utilis | Cyberlindnera jadinii (sin. Candida utilis), llevats, ascomicets | Suplement saboritzant, alternativa a glutamat | Metanol, melasses | Phillips Petroleum Co (USA) fins 2002, Provesteen Process (USA) fins 1990 | Poca rendibilitat del procés |
| Fusarium venenatum | Fong filamentós, ascomicets | “Micoproteïna”, paret rica en glucans (fibra), efectes positius a salut | Glucosa de midó, sals, N inorgànic | Marlow Foods Ltd “QuornTM” (UK), Atlastfood (USA), Nature’s Fynd (USA) i altres, en funcionament | Aparició ocasional de mutants amb miceli molt ramificat, que fan que calgui aturar el cultiu continu cada 6 setmanes. |
| Paecilomyces varioti | Fong filamentós, ascomicets | Aliment d’animals | Sucres de residus lignocel·lulòsics | Papereres de Finlàndia “Pekilo”, anys 1970-1990 | No era rentable, ara volen revifar-ho: https://www.eniferbio.fi/product/ |
Veiem a la Taula 1 un resum dels principals productes que s’han desenvolupat, la majoria des dels anys 1970, quan amb les primeres crisis energètiques i ambientals es cercaren alternatives a la producció de proteïna càrnica, si bé la majoria d’aquests productes no han tingut gran desenvolupament industrial i/o comercial.
Com veiem, hi ha uns quants productes que són microalgues o cianobacteris, tots ells microorganismes fotosintètics, que són interessants pel seu baix cost de producció en necessitar només llum i una mica de CO2 i algunes sals. D’aquests cal destacar els coneguts com Spirulina o espirulina, que són cianobacteris i que ja han estat una font alimentària des del temps dels asteques i altres pobles d’Amèrica central, així com dels pobles del voltant del Txad. Avui dia s’utilitza com a suplement alimentari humà, en forma de pastilles o pólvores (Figura 5), i també s’empra com a suplement alimentari en l’aqüicultura i les indústries d’aviram. Un dels principals beneficis és l’alt contingut en vitamina B12. Tanmateix, cal controlar bé el producte ja que ocasionalment pot haver-hi contaminacions amb cianotoxines o la presència de pesticides i altres compostos tòxics, sobretot si es consumeix habitualment (Grosshagauer et al., 2020).

Figura 5. Suplements en pólvores i en pastilles a base de “Spirulina”, cianobacteris. Imatge treta de Iswari.com.
De bacteris, a banda dels cianobacteris, se n’han fet assajos amb molt diversos, com alguns Bacillus, Corynebacterium i Rhodopseudomonas, però a nivell industrial com a SCP els que més èxit han tingut són els metilòtrofs i/o metanòtrofs (Taula 1), que contenen molta proteïna (50-80% del pes sec), són rics en aminoàcids essencials com la metionina, i quantitats rellevants de lípids i vitamines. Ja als anys 1970 la britànica ICI desenvolupà el producte “Pruteen” amb Methylophilus methylotrophus a partir de metanol, i actualment Calysta Inc. (producte “FeedKind”) i altres empreses estan produint Methylococcus i altres metanòtrofs convertint el metà, excedent en granges, en proteïna bacteriana (Ritala et al. 2017).
El problema principal dels bacteris —i dels fongs— és el seu alt contingut en àcids nucleics, sobretot RNA, degut al seu ràpid creixement i síntesi de proteïnes, que requereix ràtios elevades de transcripció i traducció. Això no passa amb els fotosintètics (microalgues i cianobacteris) que creixen més lentament. La ingestió de purines derivades del RNA fa augmentar la concentració d’àcid úric en plasma, que pot provocar gota i pedres al ronyó. Per tant, cal eliminar en part aquests àcids nucleics durant el procés d’elaboració de SCP. El mètode més usual és la combinació de tractament tèrmic suau amb l’ús de ribonucleases (Ritala et al. 2017).
Un cas prometedor de bacteris són els quimiolitòtrofs oxidadors d’hidrogen que també són fixadors de nitrogen N2, com Azonexus i els Comamonadaceae. Es coneixen com “mastegadors d’aire” (air-munching microbes) (De Sousa 2021) perquè poden créixer només amb N2, O2, CO2 i H2, oxidant l’hidrogen amb O2 i fixant el N2 atmosfèric (Figura 6). Però com que el H2 és quasi inexistent a l’atmosfera, cal proporcionar-lo, obtenint-lo per hidròlisi de l’aigua amb energies verdes. L’avantatge principal de que són fixadors de N2 és l’estalvi d’amoni, la producció del qual requereix molta energia, a banda del rendiment en proteïna (Hu et al., 2020). Actualització a 25 gener 2024 respecte a això: la proteïna microbiana Solein, obtinguda d’aquests bacteris comença a ser produïda per l’empresa finesa Solar Foods, amb un primer producte “Fazer taste the future snack bar“, a base de xocolata amb la proteïna bacteriana afegida, presentada a Singapur; cliqueu aquí per a més info.
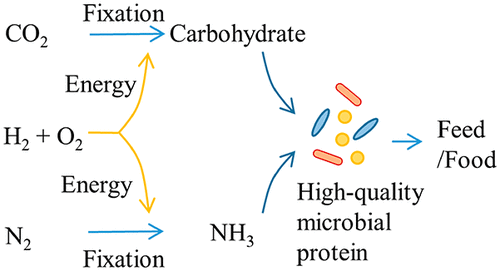
Figura 6. Esquema del metabolisme dels bacteris oxidadors d’hidrogen fixadors de nitrogen. Tret de Hu et al. (2020).
Els fongs i llevats dominen el mercat mundial de SCP per al consum humà, ja que els llevats sobretot tenen una llarga història d’acceptació, sobretot en forma d’extractes. Lògicament, la majoria de llevats comercialitzats com a SCP ho són de Saccharomyces cerevisiae, però també n’hi ha de Torula utilis, Candida i Kluyveromyces. Els llevats i altres fongs també tenen l’inconvenient del contingut en àcids nucleics (un 10%), menor que als bacteris, però que també requereix del processat per reduir-los.
El fong micelial més utilitzat com a SCP és sens dubte Fusarium venenatum, sobretot comercialitzat amb el nom de QuornTM per Marlow Foods Ltd. des de 1985. De fet, és l’únic producte SCP utilitzat exclusivament per a consum humà. Com altres fongs, a banda de l’elevat contingut de proteïna (micoproteïna), és una bona font d’aminoàcids essencials, vitamines i sobretot glucans, que contribueixen a l’aportació de fibra a la dieta. És un ascomicet, considerat un microfong (Figura 7) per l’absència de cossos fructífers macroscòpics, com també ho són Penicillium, Aspergillus i molts altres fongs filamentosos no bolets.

Figura 7. Micrografia electrònica (350 x) del miceli del fong Fusarium venenatum a la superfície del producte Quorn. Imatge treta de Ugalde & Castrillo (2002).
La producció de F. venenatum es fa en bioreactors continus amb aeració en un medi aquós amb glucosa obtinguda per hidròlisi del midó, una font de N, vitamines i minerals. El miceli resultant s’extreu (Figura 8) i es fa el tractament per eliminar el RNA, i s’asseca.

Figura 8. Traginant una capa de miceli de Fusarium. Foto de MyForest Foods Co, treta de Dietrich (2022).
Els productes amb micoproteïna com Quorn en concret estan pensats sobretot com a succedani de la carn, i es venen sobretot en forma de plats preparats, amb una varietat enorme de gustos i textures (Figura 9), lògicament afegint additius. Com a curiositat, vegeu el web publicitari de Quorn (www.quorn.co.uk), amb profusió de receptes i suggeriments. La majoria dels productes contenen albúmina d’ou a més del fong, que actua com a lligant. Les formulacions veganes substitueixen l’ou per patata.

Figura 9. Exemples de productes fets amb F. venenatum: pseudosalsitxes Quorn i crema de formatge no lacti de Nature’s Fynd. Imatges respectives de quorn.co.uk i de Dietrich 2022.
L’interès en la SCP és cada cop més gran, i la recerca i desenvolupament relacionades està augmentant molt, sobretot a la Xina, on des del 2001 s’han registrat el 70% de patents mundials de SCP, sovint relacionades amb l’aprofitament de residus agrícoles com el metà (Ritala et al. 2017).
En qualsevol cas, cal contemplar la proteïna microbiana com un més dels elements a tenir en compte, a més dels altres comentats, en la necessària transformació necessària del sistema agroalimentari, combinant-lo amb la reducció dels residus alimentaris, l’incentiu de menjar més saludable, i la comercialització de productes amb menor impacte ambiental que els actuals (Carrington 2022).
———-
BIBLIOGRAFIA
Berkheiser K (2019) Four potential side effects of nutritional yeast. Nutrition, Healthline, 8 aug 2019.
Carrington D (2022) Swapping 20% of beef for microbial protein “could halve deforestation” The Guardian News website, Food, 4 May 2022.
Bingham L (2020) Cultured meat: better than the real thing ? Foodunfolded, 10 march 2020.
De Sousa A (2021) How air-munching microbes could grow the fake meat of the future. Bloomberg Europe edition website, 11 October 2021.
Dietrich T (2022) Microbes and mushrooms -the future of Earth-friendly food. National Science Foundation website, 20 January 2022.
Godwin R (2021) If we want to save the planet, the future of food is insects. The Guardian News website, The Observer Food, 8 May 2021.
Grosshagauer S, Kraemer K, Somoza V (2020) The true value of Spirulina. J Agric Food Chem 68:4109.
Hidrofílic (2017) Petjada hídrica. Aigües.net, 13/01/2017.
Hooper R (2022) Farming is the most destructive human activity ever (Interview with George Monbiot). New Scientist website, 19 May 2022.
Hu X, Kerckhof FM, Ghesquière J, Bernaerts K, Boeckx P, Clauwaert P, Boon N (2020) Microbial Protein out of Thin Air: Fixation of Nitrogen Gas by an Autotrophic Hydrogen-Oxidizing Bacterial Enrichment. Environ Sci Tech 54:3609
Humpenöder, F., Bodirsky, B.L., Weindl, I. et al. (2022) Projected environmental benefits of replacing beef with microbial protein. Nature 605, 90–96.
Junaid F, Khawaja LA, Sikander A (2020) Single cell protein as a potential meat substitute: a critical review. World J Pharmac Res 9:141.
Kadim IT, Mahgoub O, Baqir S, Faye B, Purchas R (2015) Cultured meat from muscle stem cells: a review of challenges and prospects. J Integr Agric 14, 222–233.
Lange KW, Nakamura Y (2021) Edible insects as future food: chances and challenges. J Future Foods, 1, 38-46
Mekonnen MM, Hoekstra AY (2010) The green blue and grey water footprint of farm animals and animal products. Value of Water Research Report Series n. 48, UNESCO-IHE
Petrusán JI, Rawel H, Huschek G (2016) Protein-rich vegetal sources and trends in human nutrition: A review. Curr Topics Pept Prot Res 17, 1-19
Poore J, Nemecek T (2018) Reducing food’s environmental impacts through producers and consumers. Science 360, 987–992
Quorn: https://www.quorn.co.uk
Ritala A, Häkkinen ST, Toivari M, Wiebe MG (2017) Single cell protein —State-of-the-Art, Industrial landscape and Patents 2001-2016. Front Microbiol 8, 2009
Ugalde UO, Castrillo JL (2002) Single cell proteins from fungi and yeasts. Appl Mycol Biotech 2:123
Velsid (2022) Producción de filetes de pescado a partir de la técnica para cultivar organoides. Gastronomía y Cía, República. 8 set 2022
Microbis domesticats per fer vi
24 agost 2022
A banda d’animals i plantes, els humans també hem anat “domesticant” alguns microbis al llarg de la història, en anar desenvolupant els aliments fermentats. Els grups principals d’aquests microorganismes són els bacteris làctics de molts productes lactis i vegetals fermentats, els llevats de les begudes alcohòliques, i les floridures d’alguns formatges i derivats de la soja. En aquest article, després d’una breu introducció, em limito sobretot als microbis del vi, o sigui, als llevats de la fermentació alcohòlica com Saccharomyces cerevisiae i als bacteris de la fermentació malolàctica com Oenococcus oeni.
DOMESTICACIÓ
Quan el flux genètic entre poblacions de la mateixa espècie es redueix, usualment per aïllament, l’evolució pot donar lloc a subpoblacions diferents, que eventualment poden esdevenir espècies diferents. Els humans poden interferir en aquest procés natural limitant el flux genètic deliberadament, seleccionant determinats trets desitjats, o sigui, la selecció artificial. D’aquesta manera, algunes espècies acaben essent dependents d’ambients antropogènics i adquireixen trets evolutius que interessen als humans. Això és la domesticació.
Els trets buscats són molt diversos, des del rendiment (ex. ramaderia bovina o ovina o l’agricultura intensiva), passant per la tolerància al estrès (ex. collites resistents a sequera), fins arribar a l’estètica (ex. flors) o a la companyia (ex. gossos). Amb l’excepció dels gossos ja domesticats fa uns 30.000 anys, la majoria d’espècies domesticades ho foren durant la revolució neolítica fa uns 12.000 anys, amb el canvi de nomadisme de caçar i recol·lectar al sedentarisme lligat als conreus i al bestiar. En seleccionar els descendents d’animals i plantes que millor cobrien les necessitats específiques, aquests humans prehistòrics efectivament van començar a controlar els processos de selecció i el flux genètic (Steensels et al. 2019).
DOMESTICACIÓ DE MICROORGANISMES
Comparat amb la de plantes i animals, la domesticació de microbis ha estat ignorada molt de temps. Recentment, el gran augment de dades genòmiques disponibles ha permès conèixer amb precisió les relacions genètiques entre diferents microorganismes, amb la qual cosa s’ha vist que els microbis industrials sovint representen branques genètiques diferenciades i aïllades als arbres filogenètics. Tanmateix, les circumstàncies ambientals que la domesticació microbiana requereix i les característiques genètiques concretes no s’han estudiat amb detall.
Curiosament, mentre que la domesticació d’animals i plantes són sobretot el resultat de l’esforç humà a posta, la domesticació dels microbis ha succeït sobretot sense intenció. Cal recordar que l’existència dels microorganismes començà a finals del s. 17 amb Antoni van Leeuwenhoek, el seu paper a les fermentacions no fou desvelat fins al s. 19 amb Louis Pasteur i altres, i sobretot els primers cultius purs, en concret de llevats cervesers, no foren obtinguts fins a finals del s. 19 per Emil C. Hansen a la Carlsberg.
Però és clar, les fermentacions són conegudes des del neolític o abans, encara que no se sabés res dels microbis com a tal. Un dels primers passos per controlar una mica el procés de fermentació fou probablement la retro-inoculació (backslopping en anglès), on s’utilitza material —i per tant microbis— d’una fermentació prèvia per començar-ne una de nova. Amb això, aquells antics artesans van promoure sense pretendre-ho l’adaptació dels microbis a l’ambient fermentatiu antropogènic, i per tant fou una selecció “inconscient”.
Al llarg del procés de domesticació dels microbis, hi ha una competència contínua entre diferents variants, ja siguin espècies, soques o mutants, a cada ronda de fermentació. O sigui, també hi ha una supervivència dels més adaptats, com a la selecció natural, encara que aquí és en un ambient controlat pels humans. En canvi, això ha canviat aquests darrers decennis des que s’utilitza la inoculació de cultius purs, seleccionats prèviament en base a les característiques volgudes. Aquesta selecció més “artificial” s’assembla més a la domesticació tradicional d’animals i plantes. La introducció de les noves eines biotecnològiques aquests darrers anys ha permès dissenyar encara millor el microorganisme amb les propietats desitjades per a la fermentació, incloent-ne algunes, com la producció d’aromes exòtics, que no necessàriament donen un avantatge adaptatiu del microbi.
Recomano la revisió de Steensels et al. (2019) per repassar les característiques del procés de domesticació als principals grups de microbis industrials, que són els bacteris làctics, els llevats i les floridures. Com he esmentat al principi, aquí em centraré sobretot en els relacionats amb el procés de vinificació, o sigui llevats i bacteris làctics, i per aquest ordre, de rellevància i temporalitat al vi.
DOMESTICACIÓ DELS LLEVATS
Els llevats són fongs unicel·lulars, i per tant microscòpics. Tenen uns 4 micròmetres de diàmetre, encara que alguns poden arribar fins a 40 µm, i ocasionalment alguns fan prolongacions o cadenes de cèl·lules conegudes com pseudohifes. Es reprodueixen sobretot asexualment per mitosi amb gemmació, una divisió asimètrica on el llevat fill més petit és la gemma. En condicions d’estrès poden esporular i després de la meiosi es produeixen espores haploides, que poden conjugar. La majoria són ascomicets però també n’hi ha de basidiomicets, i encara que hi ha unes 1500 espècies de llevats, el “llevat” per antonomàsia és Saccharomyces cerevisiae.
Encara que no exclusius del vi, els llevats S. cerevisiae són el model perfecte de domesticació microbiana perquè, malgrat ser eucariotes, tenen un genoma petit (12 Mb i 6500 gens, enfront la mitjana als ascomicets que és de 36 Mb i 11000 gens) i ben estudiat, temps de generació curts i es disposa de moltes eines per fer-hi recerca genètica i fenotípica.
S. cerevisiae només és abundant a les fermentacions de fruita recollida artificialment, com als raïms veremats un cop són al celler. En canvi, de forma natural s’ha trobat a molts hàbitats però en nombres escassos, i en particular a les fruites, al raïm mateix, i a l’escorça dels roure, que semblen ser els seus nínxols ecològics, però en qualsevol cas en nombres escassos (Steensels et al. 2019).
Per això s’ha proposat que S. cerevisiae no és que estigui adaptat a cap nínxol específic sinó que es pot dir que és una espècie nòmada, capaç de sobreviure com a generalista poc abundant en un ample ventall d’ambients. Pot sobreviure en molt diverses condicions i encara que el seu genoma és petit, és força complex i de fet per créixer als medis de laboratori només li calen el 20% dels seus 6500 gens (Goddard & Greig 2015).
Però malgrat no tenir clar quin és el seu hàbitat natural, està clar que el seu segon hàbitat són molts ambients artificials de fermentacions com les de pa, cervesa i vi. S. cerevisiae és conegut per les seves excel·lents característiques fermentatives, fins i tot en presència d’oxigen. Aquest caràcter sorgí com un procés evolutiu, adquirint la capacitat de créixer en medis amb molts sucres però amb pocs dels altres nutrients, i de convertir aquests diversos sucres a etanol, un compost antimicrobià per al qual aquest llevat és molt tolerant. El vi es considera la primera beguda fermentada alcohòlica, de fa uns 9000 anys (Fay et al. 2019). Amb tot, S. cerevisiae no és la única espècie per produir begudes alcohòliques, vins inclosos, ja que també ho són altres Saccharomyces relacionats: S. uvarum, S. eubayanus, S. kudriavzevii i altres derivats híbrids (González et al. 2006)
Com que l’etanol és un bon preservatiu natural enfront de microbis no desitjats, i addicionalment té la capacitat de ser una substància addictiva, la fermentació d’aliments per llevats va esdevenir una pràctica ben estesa, i va sorgir independentment en diverses civilitzacions arreu del món.
Per estudiar el probable origen de S. cerevisiae i la relació entre les seves diverses soques, en un estudi recent de seqüenciació i anàlisi dels SNPs (polimorfismes d’un sol nucleòtid) de més de 600 soques d’aquesta espècie (Duan et al. 2018) s’ha vist que les soques silvestres, de diversos continents però sobretot de la Xina, se separen quasi totes de les domesticades, excepte les aïllades en roures i altres Quercus, que són més properes als de les soques pròpies de vins i de cerveses (Figura 1). Com veiem, les soques domesticades es distribueixen en 2 branques evolutives. Una branca agrupa soques de fermentacions en estat sòlid, sobretot d’Àsia i en particular de la Xina. I l’altra inclou les pròpies de fermentacions líquides com els vins i les cerveses i altres, a més de les esmentades dels Quercus. Tot plegat, els autors (Duan et al. 2018) postulen un hipotètic origen de l’espècie, i sobretot de la seva domesticació, a la Xina o l’est asiàtic en general.
Aquesta proximitat evolutiva de les soques de S. cerevisiae del vi amb les dels Quercus podria ser perquè aquests arbres fossin l’origen silvestre de les víniques o també perquè hi hagués hagut un retorn a la natura d’alguna soca vínica (Steensels et al. 2019).
Les soques de llevats domesticades dels diversos processos en estat líquid, o industrials “europees”, a més de ser diferents de les silvestres, s’agrupen filogenèticament força amb l’aplicació industrial, ja sigui cervesa o vi (Figura 2). Les soques domesticades de S. cerevisiae tenen reforçats uns trets que les fan idònies per a l’ambient fermentatiu, com l’adaptació a concentració alta de sucres, ambients amb poc O2 i tolerància a l’etanol, però també alguns trets específics del producte. Per exemple, els llevats cervesers poden metabolitzar maltotriosa, sucre específic del malt, mentre que els llevats vínics tenen una bona resistència als agents antimicrobians emprats, el sulfat de coure a la vinya i el sulfurós al celler. Com veiem (Figura 2), els S. cerevisiae del vi tenen una domesticació més limitada que els cervesers. Per exemple, els cervesers han perdut la capacitat de supervivència fora de l’entorn fermentatiu, mentre que els vínics poden esporular i sobreviuen a l’entorn extern. Això segurament és degut a que la fermentació del vi només passa un cop cada any, després de la verema, i la resta de l’any els llevats han de sobreviure al celler o a l’entorn en un ambient més natural (Steensels et al. 2019).
Cal afegir a aquestes diferències entre els llevats vínics i els cervesers, la molt més gran diversitat gènica dels llevats cervesers. De fet, molts d’aquests són S. cerevisiae, que inclouen els anomenats d’alta fermentació com els de les cerveses ale i stout i moltes més de tot el món, però justament les cerveses de baixa fermentació lager, que són el 94% del mercat mundial, són dutes a terme per S. pastorianus (sinònim S. carlsbergensis), per tant una altra espècie. Aquest S. pastorianus és un híbrid al·lotetraploïde de S. cerevisiae amb el llevat criotolerant S. eubayanus, i s’originà domèsticament cap al segle 15 a Baviera sotmetent les cerveses a baixes temperatures de coves dels Alps. Per això aquest llevat actua a 7-13ºC, i al fons del fermentador (Libkind et al. 2011).
Totes les altres cerveses d’alta fermentació són elaborades amb molt diverses S. cerevisiae, constituint un grup polifilètic, amb moltes branques evolutives, algunes de les quals són filogenèticament properes a les del sake, del vi i del pa. La diversitat de nucleòtids dels S. cerevisiae cervesers és més del doble que la dels vínics. Aquesta major diversitat segurament és deguda a la suara comentada utilització estacional dels llevats vínics a diferència dels cervesers tot l’any, i també als més intensos i diferents règims de selecció associats a la seva elaboració (Gonçalves et al. 2016).
Amb tot això, tenim l’aparent paradoxa que les cerveses, com que la majoria de les consumides són lager, i moltes d’elles produïdes a gran escala industrial, semblen ser més estandarditzades comercialment i per tant més uniformes, i en canvi els vins semblen ser més diversos, en contra del que acabem de veure de la molt major diversitat de soques de llevats cerveseres que víniques.
CANVIS GENÈTICS CAP A LA DOMESTICACIÓ DE SACCHAROMYCES CEREVISIAE DEL VI
En centrar-nos en el vi, cal recordar que en començar la fermentació espontània del most de raïm les soques de S. cerevisiae no són predominants i hi ha un ampli espectre d’altres llevats, coneguts com no-Saccharomyces: Hanseniaspora, Pichia, Lachancea, Metschnikowia o Torulaspora i altres gèneres (Fleet et al. 1984). Per efecte de la producció d’etanol, S. cerevisiae acaba predominant i desplaçant en nombre a las no-Saccharomyces. Encara que cada cop més s’estan veient els beneficis d’aquests altres llevats a nivell d’aromes i s’estan utilitzant com a estàrters addicionals a S. cerevisiae (Jolly et al. 2014), no es pot parlar de la domesticació d’aquests no-Saccharomyces perquè no tenen fins ara un paper primordial en la vinificació, no es pot elaborar cap vi només amb aquests altres llevats. Per tant aquí em limitaré a S. cerevisiae.
Molts dels mecanismes de canvis genètics que han portat a la domesticació de S. cerevisiae a la vinificació són presents també en altres espècies domesticades, tant microbianes com animals i plantes. El mecanisme més fàcil d’establir com a canvi genètic són els SNPs, degudes a mutacions puntuals d’un sol nucleòtid, però s’ha vist que aquests SNPs representen tan sols una petita fracció dels relacionats amb la domesticació de S. cerevisiae, i en canvi la majoria són rearranjaments estructurals del genoma, com els següents.
Les variacions en el nombre de còpies (CNV en anglès) són mutacions molt freqüents a molt diversos organismes, on fragments de DNA de > 1kb són repetits, tenen diverses còpies, amb nombre variable. El cas més conegut en els llevats vínics és el gen CUP1, que codifica per a una metal·lotioneïna, proteïna captadora de coure. Algunes soques poden tenir fins a 18 còpies d’aquest gen, amb la qual aquests S. cerevisiae vínics produeixen més quantitat de la proteïna i per tant són més tolerants al coure de la “barreja de Bordeus” usada com a fungicida a les vinyes (Steensels et al 2019).
Els rearranjaments cromosòmics, amb delecions, insercions o translocacions de grans fragments de cromosomes, sovint causades per transposons, són relativament freqüents en l’evolució dels llevats vínics i de Saccharomyces en general. De fet, aquests rearranjaments que poden afectar un nombre important de gens són una causa important de especiació. Un exemple n’és la tolerància al sulfit —l’antibacterià més usat en vinificació— degut a l’al·lel SSU1-R que és el producte sobreexpressat d’una translocació entre els cromosomes 8 i 16, només present als llevats vínics (Pérez-Ortín et al. 2002).
La hibridació interespecífica és un altre mecanisme de canvis que ja hem vist com a origen dels llevats domesticats a les cerveses lager. Les espècies de Saccharomyces poden hibridar molt fàcilment entre elles ja que aquests híbrids poden propagar-se per mitosi tan eficientment com els seus progenitors, encara que rarament poden fer la meiosi i per tant, quasi mai produeixen espores viables (Sipiczki 2008). Malgrat això, alguns dels llinatges híbrids poden acabar ser reconeguts com a espècies. Els casos més coneguts són l’esmentat S. pastorianus (sinònim S. carlsbergenesis) (S. cerevisiae x S. eubayanus) de les lager, i els S. bayanus (S. cerevisiae x S. eubayanus x S. uvarum) del vi (Figura 3). Tanmateix, S. bayanus és controvertit per les seves similituds amb S. cerevisiae i genera confusió de noms d’espècies amb alguna de les soques comercials més utilitzades (Sipiczki 2008).
Els híbrids també han estat clau en l’aparició de força llevats vínics, sobretot en relació a la possibilitat de fermentar a baixes temperatures. Per exemple, algunes de les soques comercials d’estàrters que fermenten vi a 15ºC són híbrids “naturals” de S. cerevisiae amb S. kudriavzevii amb poliploïdia parcial, aïllats el 1979, que tenen la bona producció d’etanol de S. cerevisiae i la tolerància al fred de S. kudriavzevii (Erny et al. 2012).
De fet, recentment la hibridació interespecífica de diversos Saccharomyces vínics —per exemple S. cerevisiae x S. uvarum— s’està realitzant als laboratoris per tal d’aconseguir soques amb millors característiques relacionades amb caràcters poligènics. La hibridació com a mètode té l’avantatge de no ser considerada una tècnica GMO (organisme modificat genèticament, en anglès) i per tant les soques poden ser transferides ràpidament a la indústria (García-Ríos et al. 2019).
La transferència genètica horitzontal (TGH) és un altre mecanisme molt important evolutivament en molts organismes i en els llevats vínics també se’n coneixen alguns casos que han contribuït a la seva domesticació. Un cas és el gen Fsy1 codificant del transportador de fructosa, que permet a S. cerevisiae la utilització de la fructosa al final de fermentació, després d’haver consumit la glucosa. És molt probable que aquest gen li fou transferit del similar de S. pastorianus, per al que presenta molta homologia (Galeote et al. 2010). Un altre cas demostrat de TGH és el del gen Fot originari d’un altre llevat, Torulaspora microellipsoides, que li permet a S. cerevisiae una millor incorporació d’oligopèptids, que li donen avantatge competitiu quan les fonts de nitrogen són escasses (Marsit et al. 2015).
LLEVATS del VI DOMESTICATS o TORNEM ALS SILVESTRES ?
Malgrat els avantatges en la fermentació del vi que ha suposat l’ús d’aquests llevats evolucionats, això ha comportat una certa uniformització en les característiques del vi, sobretot a nivell d’aromes, perquè la majoria dels llevats utilitzats pertanyen a un sol llinatge genètic de S. cerevisiae domesticat. Com a contramoviment a això i també pel desig general de productes més “naturals” o ecològics, darrerament hi ha una tendència a utilitzar microorganismes silvestres i/o autòctons enlloc de les soques “domesticades”, o deixar més les fermentacions espontànies. Això passa amb el vi però també amb la cervesa i altres begudes i aliments fermentats (Steensels et al. 2014). En el vi, la tendència principal és sobretot l’ús de llevats no-Saccharomyces, presents de forma natural a l’inici de la fermentació, com he comentat abans, que donen perfils aromàtics diferents i molt interessants (Padilla et al. 2016). I encara més, els avenços en la comprensió de la domesticació combinats amb les noves tècniques disponibles per a l’evolució dirigida de microorganismes possibilitaran la creació de nous llinatges domesticats (Steensels et al. 2019).
———————–
DOMESTICACIÓ DELS BACTERIS LÀCTICS
El vi, juntament amb la cervesa i el pa, són els productes principals lligats a la domesticació comentada del llevat, S. cerevisiae bàsicament, amb algun altre molt relacionat com hem vist. Per tant, tenim unes poques espècies d’un sol gènere amb una gamma limitada de productes. En canvi, els bacteris làctics (BL) comprenen moltes espècies i ben diverses, que intervenen a molt diversos productes, tant derivats de la llet com de vegetals i d’altres aliments (Taula 1), molts més que els 3 bàsics dels llevats. Paradoxalment i tanmateix, al vi pràcticament només tenim una sola espècie de bacteri làctic domesticat, Oenococcus oeni, com tot seguit comentaré.
Els BL són bacteris gram-positius, de baix G+C al seu DNA, no esporulats, de metabolisme fermentatiu sense respiració, que produeixen àcid làctic com a producte principal de la fermentació de carbohidrats. Del punt de vista taxonòmic són l’ordre Lactobacillales, de la classe Bacilli, dins el fílum Firmicutes. Els seus hàbitats naturals són moltes plantes, especialment els fruits rics en sucres, i els animals, especialment els mamífers i entorn les seves llets, però també a l’interior dels seus cossos, com a la microbiota de boca i digestiu.
Els BL són el grup de microorganismes més important en la producció d’aliments i begudes fermentats, als que contribueixen en aroma, textura, seguretat i qualitat. La seva domesticació fou clau en la conservació d’aliments, i va resultar en molts cultius iniciadors per a la producció d’aliments industrials fermentats.
A nivell industrial, els productes làctics més coneguts són els lactis o derivats de la llet (Taula 1), on els BL predominants són Lactococcus i diversos gèneres actuals derivats de Lactobacillus (Zheng et al. 2020). En aquests dos grups, la domesticació va anar associada a pèrdua de gens de rutes biosintètiques —d’aminoàcids per exemple— i d’estrès oxidatiu, així com adquisició per TGH de gens per a un creixement òptim en l’ambient lacti, com els d’utilització de caseïna i de lactosa (Bonham et al. 2017).
Taula 1. Aliments (i begudes) fermentats amb intervenció de bacteris làctics (BL). Els BL o bacteris de l’àcid làctic (BAL, en anglès LAB) són de l’ordre Lactobacillales del fílum Firmicutes. Taula modificada i adaptada de Leroy & de Vuyst (2004). S’ha exclòs Bifidobacterium, que hi era a l’original, perquè no es dels Lactobacillales sinó del fílum Actinobacteria. S’han actualitzat els nous noms del gènere Lactobacillus (Zheng et al 2020).
| Tipus de producte | Producte fermentat | BL predominants a, b |
| Productes lactis | Formatges | Lc. lactis, Le. mesenteroides, Lb. delbrueckii, Lb. helveticus, Lcb. casei, St. thermophilus |
| Mantega i similars | Lc. lactis, Le. mesenteroides | |
| Iogurt | Lb. delbrueckii, St. thermophilus | |
| Altres llets fermentades c | Lcb. casei, Lb. acidophilus, Lcb. rhamnosus, Lb. johnsonii | |
| Quefir | Lnb. kefiri, Lb. kefiranofaciens, Lvb. brevis | |
| Carns fermentades | Embotits europeus | Ltb. sakei, Ltb. curvatus |
| Embotits USA | P. acidilactici, P. pentosaceus | |
| Peix fermentat | Plaa-som, bagoóng, garum i altres | Clb. alimentarius, C. piscicola |
| Vegetals fermentats | Xucrut | Le. mesenteroides, Lpb. plantarum, P. acidilactici |
| Olives | Lpb. pentosus, Lpb. plantarum, Le. mesenteroides | |
| Envinagrats: cogombrets, albergínies i altres | Le. mesenteroides, P. cerevisiae, Lvb. brevis, Lpb. plantarum | |
| Kimchi | Le. mesenteroides, Le. kimchii, Ltb. sakei, Lpb. plantarum, W. kimchii, P. pentosaceus | |
| Salsa de soja | T. halophilus | |
| Cereals fermentats | Massa mare | Flb. sanfranciscensis, Lvb. brevis, Lpb. plantarum |
| Begudes alcohòliques | Fermentació malolàctica del vi | O. oeni |
| Vi d’arròs | Ltb. sakei | |
| Cerveses làmbic o similars | Pediococcus spp. |
b A banda de possibles altres microorganismes no BL
c Incloent les de probiòtics afegits
——————–
BACTERIS LÀCTICS DEL VI, OENOCOCCUS OENI I LA SEVA DOMESTICACIÓ
De la mateixa manera que amb els llevats, com que les fermentacions víniques no són estèrils, al most poden haver-hi molt diversos bacteris, incloent els BL. D’aquests, els més habituals durant la fermentació alcohòlica, si bé en nombres baixos —inferiors a 104 UFC/mL—, són Oenococcus oeni, Lactiplantibacillus plantarum, Lentilactobacillus hilgardii, Levilactobacillus brevis, Fructilactobacillus lindneri, Pediococcus parvulus i algun altre (Capozzi et al. 2021).
Però al final de la FA, quan el contingut d’etanol produït pels llevats ja és superior a 10% (v/v), aleshores la gran majoria de bacteris inclosos quasi tots els BL són inhibits, i pràcticament només hi romanen —i hi poden créixer lleugerament— les soques de O. oeni (Franquès et al. 2017), que duen a terme la fermentació malolàctica (FML) o conversió de L-màlic a L-làctic. Aquesta FML té els beneficis de reducció de l’acidesa, millora organolèptica i estabilitat microbiològica del vi (Bartowsky 2008). A banda de O. oeni, ocasionalment en alguns vins la FML pot ser duta a terme per altres BL, sobretot per Lpb. plantarum (Krieger-Weber et al. 2020).
Per tant, Oenococcus oeni és el bacteri del vi per excel·lència, degut a la seva tolerància a l’etanol i la capacitat de sobreviure en un medi àcid i amb polifenols i amb ben pocs nutrients com és el vi. La seva excepcionalitat està clar que va lligada a la seva domesticació —involuntària per als humans— i adaptació a aquest entorn artificial del vi durant aquests darrers milers d’anys.
CANVIS GENÈTICS CAP A LA DOMESTICACIÓ DE OENOCOCCUS OENI AL VI
Els bacteris gram-positius amb fermentació heterolàctica de sucres i forma de coc que realitzen la FML del vi foren classificats com Leuconostoc oenos per Garvie (1967) per la semblança amb altres Leuconostoc. Tanmateix, els del vi es distingeixen dels altres Le. pel creixement en medi àcid, la tolerància a l’etanol, i la pobre fermentació de carbohidrats, a més de les estructures diferenciades d’enzims clau com la D-lactat deshidrogenasa o la glucosa-6-fosfat deshidrogenasa. L’estudi filogenètic del gen 16S rRNA per Yang & Woese (1989) va revelar una línia ben diferenciada d’aquests bacteris del vi respecte a altres Leuconostoc i d’altres BL (Figura 4). Aquests autors ja observaren que la seqüència del 16S rRNA de “Le. oenos“, a més de ser molt distant de tots els altres Leuconostoc, tenia inusualment alterada la composició en posicions altament conservades. Per tot això Dicks et al. (1995) van proposar el nou nom de gènere i espècie Oenococcus oeni.
Aquesta branca filogenètica ben llarga i diferenciada de O. oeni és indicativa de la ràpida evolució que aquest bacteri ha experimentat en la domesticació i adaptació al vi. Les característiques genòmiques principals d’aquesta espècie respecte a altres BL són d’una reducció gènica a tots els nivells (Makarova et al. 2006), la qual cosa es correspon amb la molt menor capacitat biosintètica (aminoàcids, vitamines, etc.):
- El genoma de O. oeni és de 1.78 Mbp, el més petit dels BL, que van de 1.8 de diversos Streptococcus a 3.3 de Lpb. plantarum.
- El nombre d’operons rRNA de O. oeni és 2, el menor de tots els BL, ja que alguns com Lb. delbrueckiii en tenen 9.
- El nombre de tRNAs de O. oeni és 43, el menor de tots els BL, enfront de 55-98 dels altres, relacionat amb el menor creixement i la menor competitivitat ecològica.
A banda de la reducció gènica, a Oenococcus s’observen taxes més elevades de mutacions que a d’altres BL, és un gènere hipermutable (Taula 2). La causa és que hi són absents els gens mutS i mutL, que són gens de reparació d’errors d’aparellament (MMR, mismatch repair), mentre que aquests gens són presents a tots els altres BL. El tipus de mutacions més freqüent són les transicions (GC –> AT i AT –> GC). Això explica l’alt nivell de polimorfisme al·lèlic, que probablement va conduir a la seva adaptació als ambients àcids i amb etanol (Marcobal et al. 2008). L’alta mutabilitat devia generar algunes mutacions beneficioses per a ambients molt restrictius com és el vi, a diferència d’altres BL, com per ex. Leuconostoc o Pediococcus, que es troben en molt diversos hàbitats. A més, el gènere Oenococcus és un exemple de com la manca dels gens MMR pot portar a la especiació.
Taula 2. Hipermutabilitat de O. oeni respecte a altres BL (adaptat de Marcobal et al. 2008)
| Espècie | Taxes de mutació espontània amb rifampicina | Taxes de mutació espontània amb eritromicina | % Transicions (GC-AT i AT-GC) / total mutacions |
| Oenococcus oeni | 1.6 x 10-6 | 1.6 x 10-6 | 83 |
| Leuconostoc mesenteroides | 1.5 x 10-8 | 4.2 x 10-9 | 28 |
| Pediococcus pentosaceus | 5.5 x 10-8 | 4.7 x 10-9 | 33 |
Aquesta hipermutabilitat ha originat la gran diversitat de soques de O. oeni que trobem en totes les regions vinícoles mundials, i quan s’estudien els seus genomes per diversos mètodes moleculars com els SNP (polimorfismes d’únic nucleòtid), s’observen (Figura 5) agrupacions de soques relacionades amb el tipus de producte, com les de xampany o de la sidra —on també és present aquest bacteri—, resultat de la domesticació-adaptació als diversos ambients on realitza la FML. També es troba O. oeni com a BL predominant a la kombutxa, la beguda de té fermentat per una comunitat de llevats, acètics i soques específiques de O. oeni i altres BL (Lorentzen & Lucas 2019).
OENOCOCCUS OENI, EL BACTERI DOMESTICAT QUASI NOMÉS PRESENT AL VI
Aquesta és potser l’evidència més clara de què O. oeni és un bacteri producte de la domesticació. De manera semblant al cas dels llevats i en aquest cas es pot dir que encara amb més certesa, és molt difícil trobar O. oeni fora del vi en ambients naturals. Les poblacions de BL al most de raïm són com a molt 104/mL, i O. oeni només és una petita part d’aquests. Hi ha molts pocs estudis on se’ls hagi pogut aïllar dels raïms o del most. En destaca el treball recent de Franquès et al. (2017) on s’aconseguiren aïllar-ne diverses soques al Priorat. Algunes d’aquestes foren també aïllades als mateixos vins, i es confirmà la presència del DNA d’O. oeni als mateixos raïms.
Malgrat la minsa presència d’aquest bacteri als raïms i al most, un cop la fermentació alcohòlica està acabant i el vi conté una quantitat significativa d’etanol produït pels llevats, els pocs inicials O. oeni poden haver assolit unes poblacions suficients per realitzar la FML. A banda del most, també és molt probable que els bacteris ja hi siguin al celler, a les superfícies o interior dels equipaments, ja que s’han detectat soques comercials de O. oeni a cellers on se n’havia utilitzat anys abans (Lorentzen & Lucas 2019).
CONCLOENT, LA DOMESTICACIÓ INCONSCIENT DELS MICROBIS DEL VI HA GENERAT DOS MOLT EXCEPCIONALS
El llevat Saccharomyces cerevisiae és l’espècie principal implicada a la fermentació alcohòlica del vi, i el bacteri làctic Oenococcus oeni ho és per a la fermentació malolàctica. En canvi, abans de les fermentacions respectives quasi no hi són. Si no s’inoculen estàrters, els nombres de S. cerevisiae són molt baixos al most, i O. oeni pràcticament no apareix al vi fins al final de la fermentació alcohòlica. Per tant, es pot dir que si els humans no haguessin començat a fer vi —i cervesa en el cas dels llevats— fa alguns milers d’anys, aquestes dues espècies segurament no existirien. Són clarament microbis domesticats en el sentit que han aparegut evolutivament en un temps relativament breu com a derivats de microbis previs que no tenien les característiques específiques d’aquests dos.
Com hem vist, l’excepcionalitat de Saccharomyces (“el fong del sucre”), i en particular S. cerevisiae, és sobretot la capacitat de fermentar medis amb molts sucres, convertint-los a etanol en quantitats importants, per al qual aquest llevat és molt tolerant. Aquesta producció d’etanol és bioquímicament excepcional i única entre els fongs i els altres organismes. Vegeu al respecte el treball de Dashko et al. (2014) sobre l’evolució de la fermentació alcohòlica als llevats.
L’excepcionalitat d’O. oeni (“el coc del vi del vi”) també és ben evident. És una espècie “nascuda i modelada” al vi (Bech-Terkilsen et al. 2020), capaç de sobreviure en un medi ben hostil, amb etanol, pH baix i molt pocs nutrients. Hi subsisteix gràcies al L-màlic i algunes restes de les cèl·lules de llevats, com és el cas de les manoproteïnes (Balmaseda et al. 2021), i és resistent a l’estrès d’aquestes condicions extremes gràcies a algunes proteïnes protectores del xoc de l’etanol, als sistemes antioxidants com el glutatió (Margalef-Català et al. 2016), i també en part degut a l’acumulació de manganès —també antioxidant, i molt poc estudiat—, el qual a més és cofactor de l’enzim malolàctic (Makarova et al. 2006). Per tot això, O. oeni pot ser una espècie model d’estrès per als altres BL (Liu 2002).
BIBLIOGRAFIA
Balmaseda A, Aniballi L, Rozès N, Bordons A, Reguant C (2021) Use of yeast mannoproteins by Oenococcus oeni during malolactic fermentation under different oenological conditions. Foods 10, 1540
Bartowsky EJ (2008) Oenococcus oeni and malolactic fermentation —moving into the molecular arena. Aust J Grape Wine Res 11: 174-187
Bech-Terkilsen S, Westman J, Swiegers J, Siegumfeldt H (2020) Oenococcus oeni, a species born and moulded in wine: a critical review of the stress impacts of wine and the physiological responses. Aust J Grape Wine Res 26, 188-206
Bonham KS, Wolfe BE, Dutton, R.J. (2017) Extensive horizontal gene transfer in cheese-associated bacteria. Elife 6, e22144
Campbell-Sills H, El Khoury M, Favier M, Romano A, Biasioli F et al. (2015) Phylogenomic Analysis of Oenococcus oeni Reveals Specific Domestication of Strains to Cider and Wines. Genome Biol Evol 7, 1506–1518
Capozzi V, Tufariello M, De Simone N, Fragasso M, Grieco F (2021) Biodiversity of Oenological Lactic Acid Bacteria: Species- and Strain-Dependent Plus/Minus Effects on Wine Quality and Safety. Fermentation 7, 24
Dashko S, Zhou N, Compagno C, Piškur J (2014) Why, when, and how did yeast evolve alcoholic fermentation?. FEMS Yeast Res, 14, 826–832
Dicks LMT, Dellaglio F, Collins MD (1995) Proposal to reclassify Leuconostoc oenos as Oenococcus oeni [corrig.] gen. nov., comb. nov. Int. J. Syst. Bacteriol. 45, 395–397
Duan SF, Han PJ, Wang QM, Liu WQ, Shi JY et al (2018). The origin and adaptive evolution of domesticated populations of yeast from Far East Asia. Nat. Commun. 9, 2690
Erny C, Raoult P, Alais A, Butterlin G, Delobel P et al. (2012) Ecological Success of a Group of Saccharomyces cerevisiae/Saccharomyces kudriavzevii Hybrids in the Northern European Wine-Making Environment. Appl Environ Microbiol 78, 9
Fay JC, Liu P, Ong GT, Dunham MJ, Cromie GA et al. (2019) A polyploid admixed origin of beer yeasts derived from European and Asian wine populations. PLoS Biol 17(3): e3000147
Fleet GH, Lafon-Lafourcade S, Ribereau-Gayon P (1984). Evolution of yeasts and lactic acid bacteria during fermentation and storage of Bordeaux wines. Appl Environ Microbiol 48, 1034–1038
Franquès J, Araque I, Palahí E, Portillo MC, Reguant C, Bordons A (2017) Presence of Oenococcus oeni and other lactic acid bacteria in grapes and wines from Priorat (Catalonia, Spain). LWT Food Sci Technol 81, 326-334
Galeote V, Novo M, Salema-Oom M, Brion C, Valerio E et al. (2010) FSY1, a horizontally transferred gene in the Saccharomyces cerevisiae EC1118 wine yeast strain, encodes a high-affinity fructose/H+ symporter. Microbiology 156, 3754–3761
Gallone B, Steensels J, Prahl T, Soriaga L, Saels V et al (2016) Domestication and divergence of Saccharomyces cerevisiae beer yeasts. Cell 166, 1397–1410.e1316
García-Ríos E, Guillén A, de la Cerda R, Pérez-Través L, Querol A, Guillamón JM (2019) Improving the Cryotolerance of Wine Yeast by Interspecific Hybridization in the Genus Saccharomyces. Front Microbiol 9, 3232
Garvie EI (1967) Leuconostoc oenos sp. nov. J Gen Microbiol 48, 431–438
Goddard MR, Greig D (2015) Saccharomyces cerevisiae: a nomadic yeast with no niche ? FEMS Yeast Res. 15, 1–6
Gonçalves M, Pontes A, Almeida P, Barbosa R, Serra M et al (2016) Distinct Domestication Trajectories in Top-Fermenting Beer Yeasts and Wine Yeasts, Current Biology 26, 2750-2761
González SS, Barrio E, Gafner J, Querol A (2006) Natural hybrids from Saccharomyces cerevisiae, S. bayanus and S. kudriavzevii in wine fermentations. FEMS Yeast Res 6, 1221–1234
Krieger-Weber S, Heras JM, Suarez C (2020) Lactobacillus plantarum, a New Biological Tool to Control Malolactic Fermentation: A Review and an Outlook. Beverages 6, 23
Leroy F, De Vuyst L. (2004). Lactic acid bacteria as functional starter cultures for the food fermentation industry. Trends Food Sci Technol 15, 67–78
Libkind D, Hittinger CT, Valério E, Gonçalves C, Dover J et al (2011). Microbe domestication and the identification of the wild genetic stock of lager-brewing yeast. Proc Nat Acad Sci, 108(35), 14539-14544
Liu SQ (2002) A review: Malolactic fermentation in wine — Beyond deacidification. J Appl Microbiol 92, 589–601
Lorentzen MPG, Lucas PM (2019) Distribution of Oenococcus oeni Populations in Natural Habitats. Appl Microbiol Biotechnol 103, 2937–2945
Jolly NP, Varela C, Pretorius IS (2014) Not your ordinary yeast: non-Saccharomyce yeasts in wine production uncovered. FEMS Yeast Res, 14, 215–237
Makarova K, Slesarev A, Wolf Y, Sorokin A, Mirkin B et al. (2006) Comparative genomics of the lactic acid bacteria. Proc Natl Acad Sci U S A. 103:15611–15616
Marcobal AM, Sela DA, Wolf YI, Makarova KS, Mills DA (2008) Role of hypermutability in the evolution of the genus Oenococcus. J Bacteriol 190, 564-570
Margalef-Català M, Araque I, Weidmann S, Guzzo J et al. (2016) Protective roles of glutathione addition against wine-related stress in Oenococcus oeni. Food Res Internat 90, 8-15
Marsit S, Mena A, Bigey F, Sauvage F, Couloux A. et al. (2015) Evolutionary advantage conferred by an eukaryote-to-eukaryote gene transfer event in wine yeasts. Mol Biol Evol 32, 1695–1707
Ono J, Greig D, Boynton PJ (2020) Defining and Disrupting Species Boundaries in Saccharomyces. Ann Rev Microbiol 74,477-495
Padilla B, Gil JV, Manzanares P (2016) Past and future of non-Saccharomyces yeasts: from spoilage microorganisms to biotechnological tools for improving wine aroma complexity. Front Microbiol 7, 411
Pérez-Ortı́n JE, Querol A, Puig S, Barrio E (2002) Molecular Characterization of a Chromosomal Rearrangement Involved in the Adaptive Evolution of Yeast Strains. Genome Res 12, 1533-1539
Steensels J, Gallone B, Voordeckers K, Verstrepen KJ (2019) Domestication of industrial microbes. Curr Biol 29 R381 (Review)
Sipiczki M (2008) Interspecies hybridization and recombination in Saccharomyces wine yeasts. FEMS Yeast Res 8, 996-1007
Steensels J, Snoek T, Meersman E, Picca Nicolino M et al (2014) Improving industrial yeast strains: exploiting natural and artificial diversity. FEMS Microbiol Rev 38, 947–995
Yang D, Woese CR (1989) Phylogenetic structure of the ‘‘Leuconostocs’’: an interesting case of a rapidly evolving organism. Syst Appl Microbiol 12, 145–149
Zheng J, Wittouck S, Salvetti E et al (2020) A taxonomic note of the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostococaceae. Int J Syst Evol Microbiol 004107
Llicenciats en Biotecnologia per la URV, 10 anys després
21 febrer 2022
| En memòria de l’Albert Almasqué, que fou alumne destacat de la 1a promoció d’estudiants de Biotecnologia de Tarragona. També fou el seu primer estudiant Erasmus (a Bolonya 2007-08), i coordinador de la 1a Jornada de Biotecnòlegs de Catalunya (abril 2010) de la ASBTEC. Malauradament va morir l’agost de 2011. El recordem amb afecte. |  |
MOTIUS D’AQUEST ARTICLE
El motiu principal ha estat la meva estreta relació amb aquestes noies i nois —actualment adults— que van estudiar la llicenciatura de Biotecnologia a la Universitat Rovira i Virgili (URV) a Tarragona, perquè vaig ser coordinador del disseny, elaboració i posta en marxa del pla d’estudis d’aquesta llicenciatura. A més a més, els vaig tenir a tots ells com a alumnes de 1 o 2 assignatures i vaig fer de tutor d’uns quants d’ells. Van ser 4 promocions, des dels que van començar el curs 2005-06 i van acabar pel 2009, fins als que van començar el curs 2008-09 i van acabar pel 2012, un total de 154 llicenciats.
La meva relació prèvia amb els estudis de Biotecnologia va començar cap al 2001 quan vaig col·laborar amb el rector Lluís Arola en la documentació de la justificació, per part d’una comissió de rectors, de la llicenciatura en Biotecnologia com a títol oficial a nivell espanyol. També vaig col·laborar en la documentació de la justificació territorial i sòcio-econòmica a la URV. Un cop aprovada la implantació de la llicenciatura en Biotecnologia a la URV, el desembre del 2004 em van confiar l’encàrrec del disseny del pla d’estudis, que el vam elaborar en una petita comissió amb membres de les Facultats d’Enologia i de Química i de l’ETSEQ. En paral·lel, l’abril de 2005 vaig ser nomenat responsable de l’ensenyament de Biotecnologia.
Com a tal, durant aquells anys amb aquests alumnes, que van ser els “conillets d’índies“, vaig tenir l’honor i plaer de coordinar la posta en marxa de tots els cursos, els continguts de les assignatures, l’assignació als departaments, la concreció de les optatives, els itineraris o especialitzacions, la gestió dels projectes en empreses o institucions, les adaptacions i convalidacions amb els altres ensenyaments, l’establiment de convenis Erasmus amb altres universitats estrangeres, i l’adquisició d’equipaments als laboratoris i de fons bibliogràfics, entre altres coses.
Tota aquesta feina la vam fer professors i administradors i tècnics de la Facultat d’Enologia —el centre responsable d’aquesta llicenciatura—, i sobretot amb professors dels Departaments més implicats: Bioquímica i Biotecnologia, Química Analítica i Q. Orgànica, Química Física i Inorgànica, Enginyeria Química i Ciències Mèdiques Bàsiques. Vull agrair a tots la seva confiança en el muntatge d’aquesta llicenciatura que vam muntar entre tots: alumnes, professors, personal tècnic i de gestió, i els responsables de la URV aquells anys.
Un segon motiu d’escriure aquest article és que aquests Biotecnòlegs són els únics amb la Llicenciatura, si més no a la URV, ja que la quarta promoció 2008-12 va ser la última, perquè el curs següent 2009-10, essent jo degà de la Facultat d’Enologia, va començar el Grau de Biotecnologia, amb la posada en marxa dels Graus universitaris. Per tant, i encara que els Graus tenen la mateixa validesa que les Llicenciatures —i la mateixa duració de 4 anys en aquest cas—, no deixa de ser com si s’hagués tancat un cicle d’estudiants que han compartit el mateix pla d’estudis i el mateix entorn de professorat i infraestructures. Per tant, d’alguna manera són únics i “extraordinaris”. Per descomptat, com que la nota de tall per accedir-hi era de les més altes —i ho segueix sent per al Grau—, eren ben espavilats i molt bons alumnes.
Cal senyalar que quan es va començar el 2005 aquesta llicenciatura a la URV, i coordinament amb la Universitat de Lleida, a Catalunya només es podia estudiar Biotecnologia a la UAB, i a la resta d’Espanya només s’havia iniciat a la Pablo Olavide de Sevilla. A banda, també s’havia començat en 2 universitats privades, la de Vic i la Francisco de Vitoria de Madrid. Per tant, era una llicenciatura ben nova, i a diferència de la llicenciatura de Bioquímica de 2n cicle —2 anys—, la de Biotecnologia ja fou de 1r i 2n cicle, amb els 4 anys. De fet, aquesta llicenciatura ja tenia moltes de les característiques dels Graus, i el canvi del pla d’estudis de Llicenciatura a Grau de Biotecnologia va ser relativament fàcil.
Posteriorment, amb els Graus des del 2010, la Biotecnologia ha tingut una expansió extraordinària, de tal manera que en l’actualitat només a Catalunya es pot estudiar a 7 universitats, sense comptar altres Graus relacionats.
Un tercer motiu d’aquest article és donar una certa continuïtat a l’article que vaig escriure en aquest mateix blog a finals del 2012: https://abordons.wordpress.com/2012/09/28/els-biotecnolegs-per-la-urv-dos-anys-despres-fan-tesi-doctoral-o-treballen-al-sector/. En aquella ocasió vaig recórrer a fer una enquesta entre els que havien acabat un parell d’anys abans. Però a diferència de llavors, on només hi eren 2 promocions i feia molt poc temps que havien acabat, en aquest cas estic analitzant tots els biotecnòlegs que aquest curs farà entre 10 i 13 anys que van acabar la llicenciatura, o sigui, un nombre i un temps significatiu per veure com els ha anat i el que fan actualment.
QUI SÓN AQUESTS LLICENCIATS EN BIOTECNOLOGIA per la URV ?
Bé, no diré els noms, però aquí teniu les fotos dels actes festius de les 4 graduacions, on surten quasi tots.




Com he comentat, són 154, segons el que tinc apuntat dels llistats d’aleshores. Com és obvi a les fotos, són una gran majoria de dones, en concret 117 —un 76%—, i 37 homes —un 24%—(Figura 1).
En quant al lloc d’origen o procedència d’aquests estudiants —encara que només ho tenia apuntat d’uns 115 dels 154—, una majoria són originaris de les comarques tarragonines (un 59%), n’hi ha un 19% de la resta de Catalunya (sobretot de l’àrea metropolitana de Barcelona), un 8% del País Valencià, un 3% de les Illes Balears i un 9% de la resta d’Espanya. D’aquests n’hi ha del País Basc, Aragó, Navarra, Galícia, Andalusia, Canàries, Castella-la-Manxa, i algun altre que no recordo. També hi ha un 2% originaris d’altres països, com Equador, Mèxic o Rússia.
Cal senyalar que malgrat l’origen no catalanoparlant d’alguns d’ells —com veiem, un 11%—, i que una majoria de professors fem la docència en català, no va haver-hi mai problemes lingüístics, gràcies a la bona disposició i adaptabilitat per part d’alumnes i professors i a unes bones tutories específiques d’aquests casos.
Quan van començar la llicenciatura, la gran majoria d’ells lògicament tenien 18 o 19 anys i la via d’accés havia estat les PAU des del batxillerat. Tanmateix, també hi hagué alguns que havien fet estudis de FP i ben pocs amb altres llicenciatures.
Molts d’ells van fer la llicenciatura de Biotecnologia en els 4 anys del pla d’estudis, però uns quants d’ells la van acabar en 5 anys perquè s’ho van combinar amb estades Erasmus o Sèneca i també amb el Projecte en empreses o institucions, així com simultaniejant amb la llicenciatura en Bioquímica.
Un aspecte interessant a comentar és la Menció o especialitat dins de Biotecnologia que van assolir aquests estudiants. En funció de les optatives que cursaven podien demanar una de les 3 mencions (Taula 1), que se’ls lliurava en forma de diploma en l’acte de graduació. Com veiem, una majoria important triaven la menció de Biomedicina.
| Menció | % Llicenciats |
| Biotecnologia Molecular i Biomedicina | 70 |
| Biotecnologia, Aliments i Nutrició | 19 |
| Biotecnologia Industrial i Medi Ambient | 11 |
…………………………..
MÈTODE EMPRAT PER OBTENIR LA INFORMACIÓ
Si bé jo ja disposava de la informació bàsica suara comentada de qui eren, l’interès d’aquest article és saber què han fet un cop van acabar la llicenciatura i de què o en què treballen actualment. Per aconseguir aquesta informació he recorregut sobretot al LinkedIn, la xarxa social orientada als professionals i els negocis més emprada mundialment, que té com a finalitat posar en contacte i establir col·laboracions entre professionals qualificats, i facilitar la cerca de feines. Actualment és propietat de Microsoft i té uns 750 milions d’usuaris. D’aquests 154 llicenciats en Biotecnologia, 137 són usuaris de Linkedin i els apartats de continguts que la gran majoria d’ells tenen actualitzats i que he pogut aprofitar són lògicament sobretot els d’Experiència i d’Educació.
Per aconseguir informació dels altres que no són a LinkedIn o quan la informació d’aquest no ha estat suficient, he recorregut a les cerques de Google, i és clar als seus e-correu si els tenia, o gràcies a consultes que he fet a algun/a dels altres companys. Dels 154, finalment he aconseguit prou informació de 151 i per tant només n’hi ha 3 dels qual no he trobat res. Amb això, crec que els resultats són ben significatius, d’un 98% del total de llicenciats en Biotecnologia per la URV.
Amb tota aquesta informació he elaborat un full de càlcul Excel (que no mostro aquí) amb 154 files i unes 30 columnes de dades de tots ells, que per analitzar-les poden ser ordenades amb filtres de cada columna. A partir d’aquí en un altre full de càlcul he pogut confeccionar i analitzar els resultats de cada tipus de dades i elaborar els gràfics corresponents.
MÀSTERS I ALTRES ESTUDIS FETS
Com he dit, alguns van simultaniejar l’acabament de la llicenciatura de Biotecnologia amb la matriculació a la de Bioquímica de 2n cicle a la mateixa URV (a la Facultat de Química), ja que hi havia una part important de compatibilitat entre ambdós ensenyaments. En concret, els que ho van fer van ser un 14%, dels quals la majoria són de les primeres promocions: del 2009 (un 19% també van fer Bioquímica) i del 2010 (un 28%).
En quant als Màsters, un 82% d’aquests llicenciats en Biotecnologia n’han cursat algun. De fet, aquests 127 han realitzat un total de 160 Màsters, o sigui, una mitjana de 1.26 Màsters per persona, ja que 25 d’ells han fet 2 Màsters, i fins i tot n’hi ha 4 que han fet 3 Màsters.
Com veieu (Figura 2), els Màsters realitzats són molt diversos. N’hi ha uns 35 de matèries o àmbits bàsics o complementaris de disciplines ja estudiades una mica a la llicenciatura, com Biotecnologia, Bioquímica i Biologia Molecular, Genètica, Immunologia, Microbiologia, Enginyeria Bioquímica o Bioinformàtica. A banda d’aquests bàsics, la Biomedicina és l’àmbit preferit —com era previsible havent vist les seves preferències que hem comentat abans amb les Mencions dins la llicenciatura—, amb un total de 53 Màsters dels 160, incloent-ne d’aspectes diversos, com Ciències Mèdiques, Farmacologia, Neurociències, Psiquiatria, Reproducció humana, Clínica, Forense i altres.
Un altre àmbit amb força Màsters realitzats és el de Nutrició, Enologia i altres relacionats amb aliments, on també he inclòs alguns de vegetals. Entre aquests estan els Màsters concrets més cursats de tots els tipus: Nutrició i Metabolisme (12) i d’Enologia (9), impartits al mateix campus de Sescelades de la URV.
Els Màsters de Professorat són també dels més cursats (19), ja que són requerits per impartir classes a educació secundària. Després hi han els Màsters relacionats amb Medi Ambient, biodiversitat i sostenibilitat (8). Cal destacar també els Màsters relacionats amb Finances, negocis i màrqueting (6). Un altre tipus de Màsters ben novedosos i específics bastant cursats són els de Nanociència i nanotecnologia (6). Finalment, alguns d’aquests llicenciats han cursat Màsters relacionats amb altres àrees (5) com per exemple Comunicació, Riscos laborals, etc.
La diversitat dels Màsters realitzats també es reflexa en els llocs on han estat cursats (Figura 3). La gran majoria són Màsters oficials realitzats a les universitats públiques (95%). Malgrat que molts els han realitzat a la mateixa URV (30%), cal destacar que la proporció més gran (37%) els han fet a l’àrea de Barcelona, sobretot a la UB, UAB i UPF. La majoria de valencians d’origen, però també algun altre, han optat per realitzar Màsters d’universitats de València i Alacant (8%). A més dels senyalats de Madrid, País Basc i Navarra, també n’han fet a diverses universitats de la resta d’Espanya (Salamanca, Saragossa, Logronyo, Sevilla, Granada i Vigo). Lògicament els Màsters de negocis o màrqueting han estat fets a centres privats com el CESIF, ESADE o IUCT, sobretot de Barcelona. Els Màsters realitzats a la resta d’Europa ho han estat a Dinamarca (4), Alemanya (3), Regne Unit (2), Països Baixos, Suècia i Finlàndia.
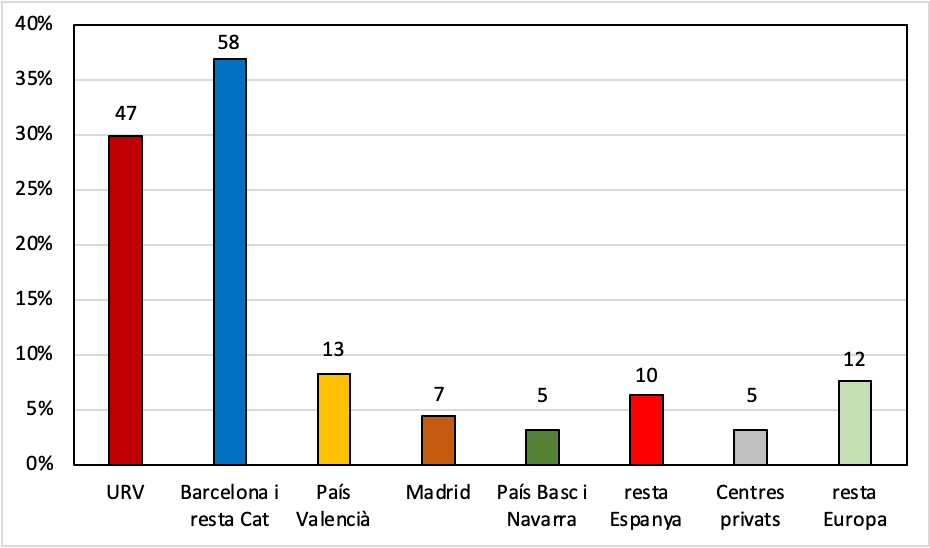
A nivell de postgrau, a banda d’altres cursos diversos que molts d’ells han realitzat, cal esmentar la superació de l’examen per tenir una plaça de BIR (Biòleg Intern Resident). És la formació sanitària especialitzada de 4 anys per a biòlegs, bioquímics i biotecnòlegs, que dóna el títol de Biòleg Especialista a nivell de tot Espanya, per poder treballar com a tal en hospitals públics o privats, de forma similar als MIR dels metges. Segons la informació de què disposo, només n’hi ha hagut una dels nostres llicenciats que va superar aquest examen i aconseguí una plaça de resident especialista, concretament en Immunologia. És una llàstima que aquesta possibilitat, ben factible i atractiva, no és gaire coneguda entre els nostres biotecnòlegs.
TESIS DOCTORALS
Entre aquests llicenciats en Biotecnologia per la URV, n’hi ha 87 que ja són Doctors, un 56%. Aquest % és molt semblant en les 4 promocions (un 55-59%). Els àmbits o àrees de les tesis doctorals són molt similars als comentats dels Màsters, amb un clar predomini dels temes de Biomedicina i lògicament molt diversos i específics segons els grups de recerca on els han realitzat. El resum dels llocs de les universitats o altres centres de recerca on han fet les tesis doctorals són els que veiem a la Figura 4.
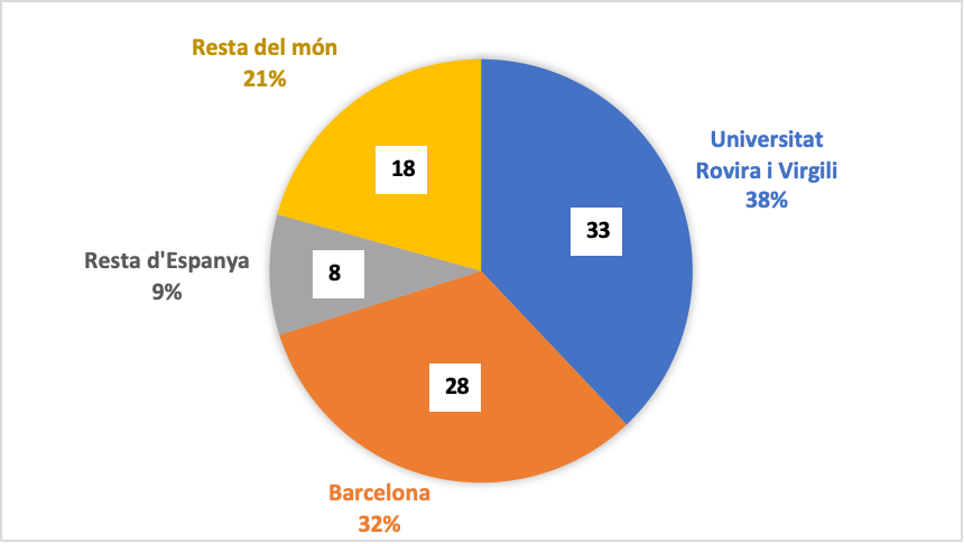
Com veiem, la proporció dels que han fet la tesi doctoral als departaments de la URV (Dpt. Bioquímica i Biotecnologia, Dpt. Ciències Mèdiques Bàsiques i Dpt. Enginyeria Química) és més gran que la dels Màsters cursats a la URV. Lògicament i en línia als Màsters, molts han fet la tesi a les universitats o altres centres de recerca de Barcelona. Els 8 que l’han fet a la resta d’Espanya han estat al País Valencià (4), País Basc, Vigo, Sevilla i Madrid.
Cal destacar el nombre elevat (18) de tesis realitzades a la resta del món, un 21%, molt més que la proporció de Màsters fets a fora (8%). Els països on s’han fet aquestes tesis són Regne Unit (4 tesis), Alemanya (3), Països Baixos (2), Suècia (2), Suïssa, Itàlia, Txèquia, Finlàndia, Estats Units, Mèxic i Austràlia.
Curiosament, el nombre de tesis realitzades a la URV fou molt més gran dels que van acabar el 2009 (14) que la resta d’anys, i en canvi, de les tesis realitzades a l’estranger només en fou una el 2009 i es disparen a la darrera promoció de 2012 amb 9 tesis, la meitat de les 18 totals.
ON SÓN ACTUALMENT aquests LLICENCIATS EN BIOTECNOLOGIA per la URV ?
He trobat informació d’on són i/o treballen actualment de 150 dels 154 llicenciats en Biotecnologia que tinc apuntats. Cal fer constar que aquí i als apartats següents comento on són actualment, però que molts d’ells durant aquests 10-13 anys transcorreguts han passat per diferents llocs i dedicacions. Per exemple, alguns dels que ara són a Catalunya o la resta d’Espanya abans han estat fent les tesis doctorals o altres estades en altres llocs, molts de l’estranger. Bastants han fet Màsters en un lloc i la tesi en un altre, i han tornat a llocs més propers al seu origen, o en algun cas, ben a l’inrevés.
Com veiem (Figura 5), lògicament els llocs on treballen ara són sobretot Tarragona i comarques tarragonines (32%) i la resta de Catalunya (29%), sobretot a l’àrea metropolitana de Barcelona. De la resta d’Espanya destaca Madrid, el País Basc i Navarra, i el País Valencià. Com veiem, és remarcable la proporció dels que són a l’estranger, un 26%. D’aquests, veiem a la part inferior de la Figura 5 els que són als diversos països d’Europa. Entre aquests en són majoria els països del nord, i és curiós que no n’hi ha cap ni a França ni a Itàlia.
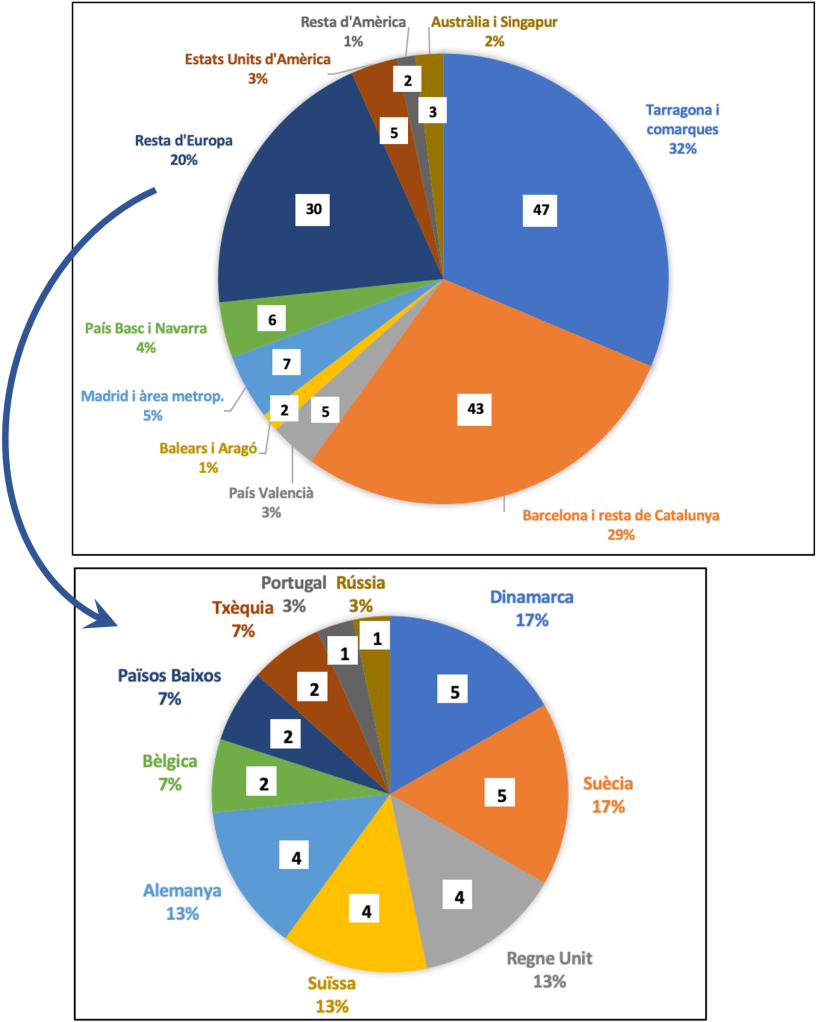
A fora d’Europa hi ha lògicament la majoria als Estats Units (5), i alguna a Mèxic, Equador, Austràlia (2) i fins i tot una a Singapur. Utilitzo el femení en aquests casos perquè totes aquestes 10 que són fora d’Europa són dones. I entre els que són a la resta d’Europa es manté la proporció aproximada de 3/4 de dones i 1/4 d’homes que hem vist del total de llicenciats. Per tant, no podem dir que en aquest cas els homes hagin estat més “aventurers” marxant ben lluny de casa que les dones, potser ha estat al revés.
Entre els que no són a l’estranger, com era d’esperar, hi ha una certa correlació amb el lloc d’origen, que és més clara per als de les comarques tarragonines, els valencians, balears, aragonesos, bascos i navarresos. No hi tanta correlació amb el lloc d’origen en els casos de Barcelona i sobretot Madrid, on hi van a treballar també d’altres llocs degut a la concentració d’empreses i institucions.
EN QUÈ TREBALLEN ACTUALMENT els LLICENCIATS EN BIOTECNOLOGIA per la URV
Dels 154 llicenciats apuntats he trobat informació de 149 en quant a l’àmbit i tipus de feina que fan. Com veiem a la Figura 6, només hi ha 10 que treballin amb temes no relacionats amb Biotecnologia. O sigui, un 93% dels llicenciats (139) treballen en àmbits o temes més o menys relacionats amb Biotecnologia, entenent aquesta en un sentit ample.
D’aquests 10 que no treballen en Biotecnologia, n’hi ha alguns tècnics d’empreses del sector químic, altres responsables de màrqueting i negocis en diverses empreses, i algun dissenyador de webs i redactor de blogs, entre altres. Els casos més sorprenents d’aquests altres, que demostren la pluralitat de formació de moltes persones incloent les vocacions artístiques, són una soprano del Liceu de Barcelona i una actriu de teatre, cine i TV. Molt d’èxits a les dues !!
Una ampla majoria dels 149 llicenciats (58% de tots, i un 62% dels que treballen en àmbits de Biotecnologia) ho fan en temes relacionats amb Biomedicina i temes relacionats amb la salut (Figura 6 part superior).
A la part inferior de la Fig. 6 veiem una distribució aproximada dels temes dins de Biomedicina. El grup més nombrós (28%) són els que estan en temes de gestió, negocis, comercials o de mercat. Els segueixen (14%) els que he agrupat com a òmiques i bioinformàtica incloent els que treballen en genètica humana. La meitat d’aquests 10 són de bioinformàtica. A la resta de les columnes de la Figura veiem altres àmbits específics destacables com l’Embriologia i reproducció humana o la Immunologia i vacunes. En el cas de Microbiologia i fongs n’hi ha alguns relacionats amb control de qualitat i altres amb recerca. Cal remarcar el nombre significatiu dels que treballen en temes ben específics com Càncer (5) o les Neurociències (4).
Entre els altres àmbits (Figura 6, part superior) veiem un 7% que treballen en empreses d’Anàlisi i diagnosi, de reactius i equipaments que s’utilitzen tant a l’àmbit biomèdic com alimentari i altres. Un 12% estan relacionats amb el camp Alimentari, on he inclòs alguns de temes agrícoles i d’animals, així com els que fan recerca en llevats, que és aplicable tant al camp alimentari com el biomèdic. Al camp Ambiental i temes d’aigües residuals o de consum s’hi dediquen un 4%. Al sector Educatiu hi són un 10%, sobretot com a professors de secundària. Finalment, uns poquets (2%) treballen en temes de Bibliometria i gestió universitària de Transferència de la recerca.
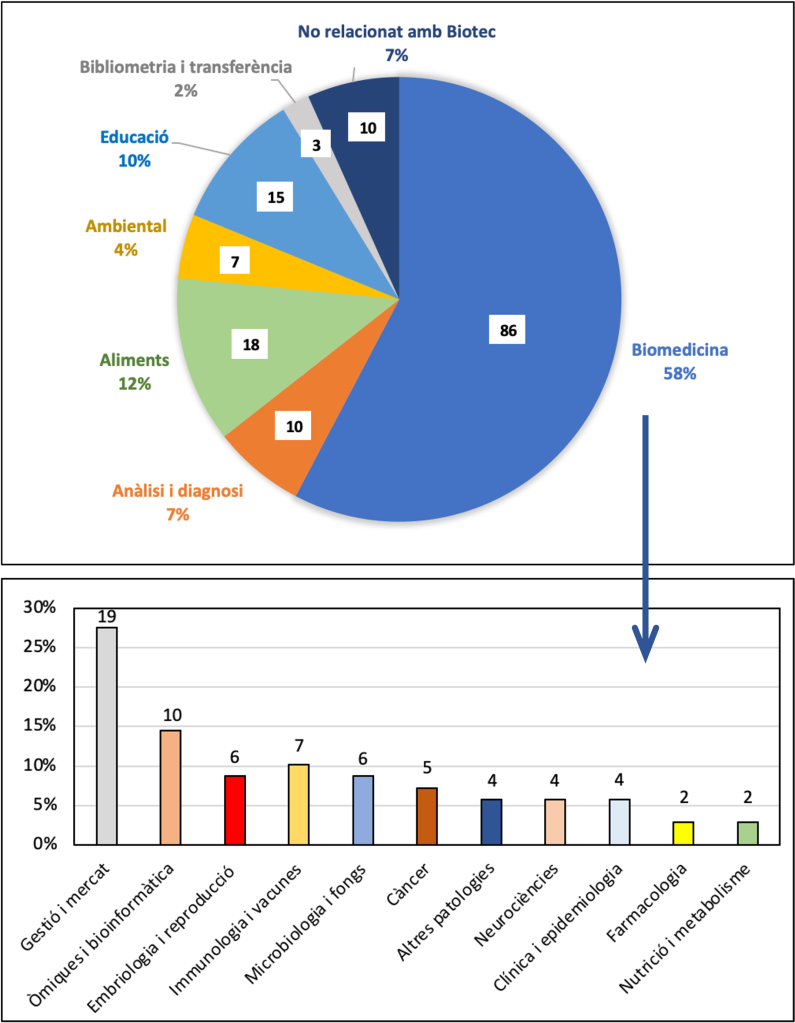
Un altre aspecte per considerar és en quin tipus d’institució o empresa i en quin sector treballen (Figura 7). Com veiem, un 4% ho fan en organismes de l’administració, en concret 3 de la Generalitat de Catalunya i 2 de la Unió Europea. A les universitats és on més n’hi ha (19%), dedicant-se majoritàriament a la recerca, sobretot amb contractes postdoctorals. Entre aquests, n’hi ha uns 4 professors a temps complet i com a mínim 3 associats.
El 10% dels llicenciats s’han immers en el món de l’ensenyament secundari. D’altra banda, un nombre important (quasi un 19%) són en centres de recerca, dels quals la majoria són públics i només un és un centre privat. Alguns (6%) treballen en centres de salut, com els d’embriologia i reproducció assistida. Totes aquestes institucions majoritàriament públiques representen el 55% dels casos.
En quant als que treballen en empreses i altres centres privats (Figura 7, columnes marrons, dreta), són el 45%. Les més freqüents són les empreses farmacèutiques (17%), seguides de les de productes de laboratori, on incloc els productes d’aplicació biomèdica (10%). També hi ha un 4% que treballen en empreses del camp de la salut, diferents de les farmacèutiques. D’altra banda, els de les empreses agroalimentàries, incloent alguna de nutrició animal, representen el 8% del total. Hi ha un 3% en empreses de temes ambientals i finalment un 1% en una empresa d’informació de publicacions científiques.
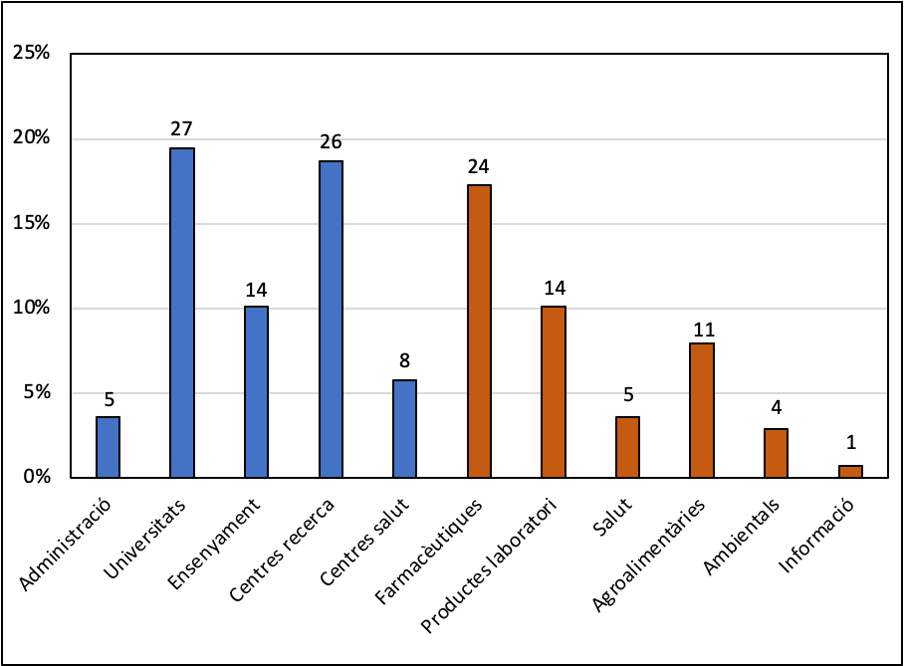
Per acabar aquest apartat, em queda comentar quin tipus de feina o contracte o càrrec tenen els 139 llicenciats que treballen en temes de Biotecnologia, independentment de l’àmbit, biomèdic o alimentari o el que sigui. Tanmateix, aquests tipus de feines són molt relatius, i aquí m’he basat exclusivament en el que ells mateixos fan constar al Linkedin.
Per fer això, en primer lloc considero separadament els que treballen en el sector públic dels que ho fan en empreses privades.
Els tipus de feina dels del sector públic es poden resumir aproximadament en aquests 4 (Taula 2):
| Investigadors i professors d’universitat a temps complet | 65% |
| Professors de secundària (algun a la privada) | 16% |
| Tècnics especialistes (en bioinformàtica, immunologia, anàlisi, etc.) | 13% |
| Responsables de projectes, estratègies, consultories, etc. | 6% |
Entre els que són al sector privat (Figura 8) hi ha un 9% que es podrien dir tècnics de gestió, incloent temes de logística, comercial, màrqueting i regulació. D’aquests mateixos temes hi ha un 8% que són caps d’alguna secció. Un altre 15% són caps de planta o de projecte.
Entre els que treballen com a tècnics, encara que és difícil fer classificacions, es pot dir que n’hi ha un 8% relacionats amb temes de qualitat, sobretot de control microbiològic. Hi destaquen els tècnics de I+D en diversos temes (35%) i d’altres es poden agrupar com a tècnics especialistes (9%), en immunologia i embriologia sobretot. Alguns d’aquests tècnics també fan tasques de recerca. Finalment, tenen contractes com a investigadors un 11%.
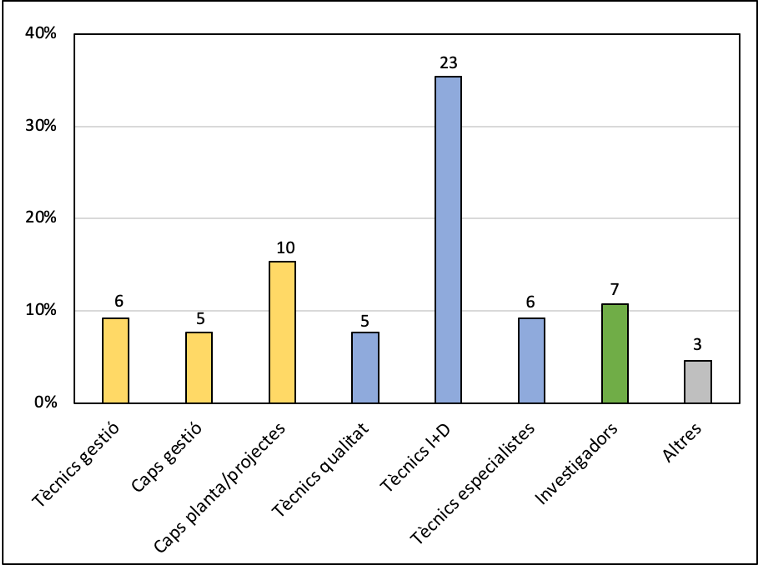
Amb això, si ajuntem els tipus de feina, tant al sector públic com el privat, aproximadament tenim aquesta distribució de tots ells (Taula 3):
| Investigadors i professors d’universitat a temps complet | 40% |
| Tècnics I+D, de qualitat i especialistes | 31% |
| Responsables de projectes, de planta, de consultories o d’altres | 14% |
| Professors de secundària | 9% |
| Tècnics en gestió, comercial, mercat, regulació i altres | 6% |
…………………………….
CONCLUSIONS
Em sembla que aquests 10 anys transcorreguts des què van acabar la llicenciatura són suficients per veure quin és el seu assoliment com a professionals. Són joves ben cert, i encara tenen moltes possibilitats de futurs èxits, però la primera impressió és que el nivell global aconseguit en aquests anys és molt bo, la gran majoria s’han seguit formant científicament amb postgraus i molts amb tesis doctorals, i la majoria d’ells treballen en temes relacionats amb biotecnologia, i sobretot, treballen dignament, cosa que avui dia no és gens fàcil.
Amb el que hem comentat, les principals conclusions de forma resumida d’aquest article són:
- Els llicenciats en Biotecnologia per la URV, de les 4 promocions (2005-2009 a 2008-2012), són una gran majoria de dones, 76%.
- Els resultats aquí mostrats són ben representatius de tots els llicenciats en Biotecnologia per la URV, ja que corresponen a la informació d’uns 151 del total de 154, o sigui, un 98%.
- Un 82% d’aquests llicenciats han realitzat algun Màster, i uns quants d’ells més d’un.
- Els àmbits majoritaris dels Màsters realitzats són Biomedicina (33%), matèries bàsiques complementàries (21%), Nutrició, Enologia i Aliments (18%) i Professorat (12%).
- El 95% de Màsters realitzats han estat en centres públics, sobretot a l’àrea de Barcelona (37%), seguits de la URV (30%), les universitats valencianes (8%) i a altres països d’Europa (8%).
- Un 56% dels llicenciats han fet la tesi doctoral i ja tenen el títol de Doctor. Els àmbits principals són semblants als dels Màsters, predominant també els temes relacionats amb Biomedicina.
- La tesi doctoral l’han realitzat majoritàriament a la URV (38%) i a l’àrea de Barcelona (32%). Cal destacar que un 21% l’han feta a l’estranger.
- Actualment treballen sobretot a Tarragona i comarques (32%) o a Barcelona i resta de Catalunya (29%). Cal destacar que un 26% són a l’estranger, la majoria d’ells a Europa, sobretot als països nòrdics. Curiosament, totes les 10 (6%) que són fora d’Europa són dones.
- La gran majoria d’aquests llicenciats treballen en àmbits relacionats amb la Biotecnologia (93%). Un 58% dels llicenciats ho fan en temes de Biomedicina. Altres àmbits rellevants són l’Alimentari (12%) i l’Educació (10%).
- Les institucions públiques on treballen són més de la meitat (55%), sobretot les universitats i centres de recerca, a més del centres d’ensenyament secundari. El tipus de feina majoritari que fan dins el sector públic és la d’investigador, inclosos els professors universitaris a temps complet (65%).
- Una mica menys de la meitat (45%) treballen en empreses, destacant les indústries farmacèutiques i de productes de laboratori, i una mica menys les agroalimentàries. Les feines predominants d’aquests biotecnòlegs dins les empreses són força diverses, des de caps de seccions de gestió o de planta, fins una majoria de tècnics I+D (35%), especialistes i alguns investigadors.
- Dels 139 que treballen en Biotecnologia comptant el sector públic i el privat, els grups majoritaris són els investigadors i professors universitaris (40%), els tècnics (31%) i un 15% que són responsables d’alguna secció de la empresa o institució.
Veient aquests resultats, haig de dir que per a mi ha estat una satisfacció haver realitzat aquest recull i comprovar que globalment són uns resultats molt bons. És un orgull veure com aquelles noies i nois s’han espavilat —que ja ho eren—, i han assolit una bona formació i unes bones feines, ja que en certa manera sóc una mica “el seu pare, el pare biotec”, tal com en broma alguns d’ells m’havien comentat algun cop.
Agraeixo a tots ells l’haver facilitat la informació, i en particular als que n’he demanat i m’han passat alguns detalls que desconeixia d’ells o d’algun dels seus companys, i també gràcies per les fotos que alguns m’han passat.
Per acabar, desitjo que aquesta informació resumida sigui útil tant per a aquests mateixos llicenciats, com també per als actuals i futurs Graduats en Biotecnologia, així com per als professors, gestors i organitzadors de la docència de la Biotecnologia de la URV i d’altres llocs, i també que pugui ser profitosa per als possibles empleadors.
La microbiota fecal desvetlla que els miners de Hallstatt fa 2700 anys tenien una dieta variada, incloent formatge blau i cervesa
1 nov 2021
Click here for the English version: Faecal microbiota from 2700 years
Fa pocs dies vaig llegir aquesta notícia al New Scientist (Wong 2021) que em va atraure de seguida: Minaires –o miners– de l’edat del ferro bevien cervesa i menjaven formatge blau i això s’ha comprovat gràcies als seus excrements fecals. Bé, em va atraure, com podeu suposar no tant per motius escatològics fisiològics –he he–, com per això del consum de cervesa i formatge blau a la prehistòria. Vaig trobar la mateixa notícia pels mateixos dies a altres publicacions digitals de divulgació científica mitjançant les xarxes socials, com per exemple a Cell Press (2021).
La notícia sintetitza –molt– un treball recentment publicat al Current Biology per un grup d’investigadors (Maixner et al 2021), sobretot del Tirol italià i d’Àustria, que han fet un estudi molt complet de mostres de femtes prehistòriques –paleofemtes– de les mines de sal de Hallstatt, a Àustria, per tal de conèixer la dieta i nutrició, i també la microbiota intestinal d’aquests miners (Figura 1).
En llegir l’article de Maixner, de seguida va augmentar el meu interès perquè toca diverses àrees que fa temps que m’interessen: a) la història i evolució de les diferents poblacions humanes; b) la microbiota intestinal; i c) els aliments fermentats i els diversos microorganismes implicats.
L’estudi multidisciplinari inclou anàlisis detallades de microscòpia, metagenòmica i proteòmica d’aquestes mostres. En concret les mostres de paleofemtes de 1-2 cm (vegeu l’aspecte a la Figura 2) són de 1300-1100 aC (edat del bronze), de 600-500 aC (edat del ferro) i de 1720-1780 dC, o sigui del segle 18. Les datacions han estat fetes amb radiocarboni 14C.

Perquè les mines de sal de Hallstatt ?
Hallstatt és un bonic petit poble a les vores d’un llac alpí a l’alta Àustria, a uns 80 km de Salzburg, a la regió de Salzkammergut (Figura 3). Com veiem, els topònims fan referència a la sal, per la importància històrica d’aquesta en l’economia de la regió. El poble és conegut sobretot per l’anomenada “cultura de Hallstatt”, el període final de l’edat del bronze (1200-800 aC) i inicial de l’edat del ferro (800-500 aC.), que es desenvolupà sobretot al centre d’Europa, a les conques altes del Rin i el Danubi.
La cultura de Hallstatt es caracteritza per l’ús avançat del treball amb metalls, ferro sobretot, i l’agricultura. Eren pobles indoeuropeus, societats tribals avançades, precursors dels celtes, i amb molt de comerç amb els pobles mediterranis. A Hallstatt hi han les mines de sal, explotades des del 1400 aC, i hi ha nombrosos enterraments d’aquesta cultura, amb molts objectes d’ús quotidià i ornamentals. L’àrea de Hallstatt-Dachstein fou declarada patrimoni cultural per la UNESCO.

Les mines subterrànies de sal de Hallstatt són de les més antigues conegudes (Figura 4), amb un registre continu d’explotació, i ofereixen unes condicions ideals de preservació. Vegeu el lloc web de la visita al museu de les mines a https://www.salzwelten.at/en/hallstatt. L’elevada concentració de sal i la temperatura constant de 8ºC a l’interior de les galeries aïllades preserven molt bé els materials orgànics relacionats amb els humans.
Des del segle 19 els arqueòlegs han estat treballant a Hallstatt, i a més de 2000 tombes protohistòriques a l’entorn del poble, a les mines s’han excavat capes denses de diversos metres de residus, descobrint milers d’eines de fusta i elements de construcció, instruments fets amb pell, centenars de fragments tèxtils de llana, herba, cordes i excrements humans, com els de les mostres d’aquest estudi.

La microbiota fecal dels miners
Per estudiar la microbiota fecal, les mostres de paleofemtes han estat tractades per Maixner et al (2021) per extreure el DNA i generar-ne biblioteques gèniques per seqüenciació multiplex amb una plataforma Illumina. Els quasi 300 milions de lectures obtingudes de seqüències de DNA han estat analitzades i comparades amb les bases de dades del NCBI per tal de conèixer la taxonomia de les espècies microbianes i d’altres.
Considerant l’edat de les mostres, el DNA danyat ha estat excepcionalment baix. Aquesta preservació tan bona probablement és deguda a la ràpida dessecació de les mostres a les mines de sal, que redueix molt el dany hidrolític de les biomolècules. La majoria del DNA identificat correspon a bacteris, un 79 a 94%, essent Firmicutes i Bacteroidetes els fílums més abundants.
De les 15 espècies més abundants identificades a les mostres (Figura 5), n’hi ha 13 que són freqüentment associades a la microbiota intestinal humana. Una de les dues “alienes” és Halococcus morrhuae, un arqueu halòfil, que normalment viu en altes concentracions de sal, i que probablement s’incorporà a partir dels cristalls de sal que envoltaven la mostra. L’altra no usual als humans sans és Clostridium perfringens, conegut patogen alimentari que causa fortes diarrees. Però com que aquest fet no s’ha detectat a les mostres, és probable que fos un contaminant, segons els autors. Com veiem a la mateixa Figura 5, les espècies identificades han estat comparades en quant a la seva prevalença en mostres actuals de poblacions no-occidentalitzades i occidentalitzades, entenent per “no-occ…” les d’estil de vida no urbanitzat, dieta amb menjar poc processat i molta fruita i verdura, higiene senzilla, i accés limitat a l’assistència sanitària i productes farmacèutics.
Entre les 13 espècies trobades com a més abundants, n’hi ha 8 Firmicutes (5 clostridials, 2 Erysipelotrichia i 1 lactobacil), 1 bacteroidal (Prevotella), 3 Actinobacteria incloent-hi 2 bifidobacteris), i 1 metanogen. Cal destacar que 5 d’aquestes més abundants són de les predominants a la microbiota de poblacions actuals no-occidentalitzades, senyalades amb triangle blau a la Figura 5. El cas més rellevant és Prevotella, el bacteroidal ben conegut en poblacions no occidentalitzades amb dietes més riques en carbohidrats i menys en proteïnes i greixos animals (vegeu el meu post sobre Bacteroides), que en les mostres de paleofemtes és al voltant del 7%. Prevotella copri en particular s’associa amb la digestió de carbohidrats complexes, components majoritaris d’una dieta vegetal rica en fibra i no processada. També és rellevant la presència de 2 bifidobacteris i un lactobacil, bacteris sovint relacionats amb productes làctics i probiòtics.
No hi ha gaire diferències entre les microbiotes de les mostres de l’edat de ferro, les del segle 18 i les de poblacions actuals no occidentalitzades. Això concorda amb què la dieta majoritària en tots aquests casos és d’aliments no processats, sobretot cereals, i fruites i verdures fresques. En efecte, en l’anàlisi microscòpica de les paleofemtes s’observen restes d’ordi, blat, mill, llegums i diversos fruits silvestres. La principal diferència en la mostra del segle 18 és que el material vegetal és molt més fi, com si hagués estat més triturat. Això suggereix que els miners protohistòrics devien menjar els cereals i llegums en una espècie de puré mentre que els del segle 18 ho devien fer en forma de pa o galetes.
En analitzar DNA animal, com era d’esperar, en el cas de l’humà, eren tots homes, mascles, els miners és clar. Respecte a altres animals que serien part de la dieta, se n’ha trobat de boví i porcí, en totes les mostres.
I menjaven formatge blau i bevien cervesa ?
Sembla que sí. Bé, de fet no ens hauria d’estranyar. Els humans coneixen i elaboren aliments fermentats (vegeu el meu post del 5 març 2021) sobre el concepte d’aliments fermentats) des de fa alguns milers d’anys. En quant als formatges i llets fermentades, és molt probable que amb la revolució neolítica agrícola en diferents llocs fa més 10000 anys (vegeu el meu post del 26 desembre 2012) ja s’aprofités la llet de diversos animals domesticats i s’elaboressin aquests productes fermentats, més duradors que la llet i més digeribles que aquesta. En quant a la cervesa, està ben registrat que els antics egipcis i mesopotamis ja n’elaboraven, en principi com a subproducte dels cereals, fa uns 6000 anys.
El treball de Maixner et al (2021) amb les paleofemtes té el mèrit de demostrar aquest consum a partir de la microbiota fecal, per part d’aquests miners de Hallstatt. En l’anàlisi metagenòmica del DNA present a les mostres han estudiat també els fongs, i han trobat sobretot en una de les mostres de l’edat del ferro (del 600 aC, fa 2600 anys) una gran abundància (fins a un 20% del DNA eucariòtic) de Penicillium roqueforti i de Saccharomyces cerevisiae, així com proteïnes d’aquests fongs a l’estudi proteòmic. Els autors han confirmat que aquests fongs són d’origen antic perquè els nivells de DNA danyat són semblants als del DNA humà endogen de les mateixes mostres. Com que P. roqueforti s’utilitza per a la fermentació de formatges i S. cerevisiae és el llevat present a l’elaboració de cervesa i vi, es pot suposar que aquests identificats haurien estat implicats en el processat d’aquests aliments d’aquella època. Per confirmar-ho, els autors han recorregut a reconstruir els genomes i fer filogènia comparativa amb soques actuals de diferents procedències.
Amb això, han vist que aquests P. roqueforti de les paleofemtes de l’edat del ferro s’assemblen genèticament a les soques de formatges blaus però no a les de Roquefort en concret. Per tant, aquests miners devien elaborar formatges blaus no-Roquefort. Malgrat la semblança, les soques modernes presenten molts fragments de soques d’altres formatges, resultat de transferència genètica horitzontal (TGH), relacionada amb la selecció i encreuaments a què han estat sotmesos, mentre que les de l’edat de ferro no presenten signes de TGH.
El suggeriment de què aquests miners consumien formatges blaus té un bon recolzament pel fet que avui dia s’elaboren amb una aplicació de sal a la superfície, fins a un 7%, la qual cosa era ben factible a l’entorn de mines de sal. El quallat i elaboració del formatge serien fetes en recipients de fusta com els trobats a les mateixes mines (Figura 6). Aquests formatges blaus, a banda d’aportar nous aromes i textures, tenen els avantatges –com la majoria de formatges i llets fermentades– de molt llarga caducitat i baix contingut en lactosa, la qual cosa afavoreix la digestió, sobretot en pobles amb baixa tolerància, com devia ser el cas en aquella època.

En el cas de les S. cerevisiae, les de l’edat del ferro han estat comparades amb 157 soques actuals de pa, cerveses, vins, sake, bioalcohols, de laboratori i silvestres. En una primera anàlisi s’ha constatat que les de les paleofemtes s’assemblen més a les de vi i cervesa, i són ben diferents de les silvestres. Per tant, eren soques ja domesticades en l’elaboració de begudes alcohòliques. En una PCA (Figura 7) s’ha vist més similitud amb S. cerevisiae de cerveses actuals, en concret d’un grup de cerveses (beer 2), més properes a les del vi. Les anàlisis d’alguns gens marcadors i la proteòmica també han confirmat que les soques antigues estaven relacionades amb la fermentació alcohòlica, sigui de cerveses o de vins.
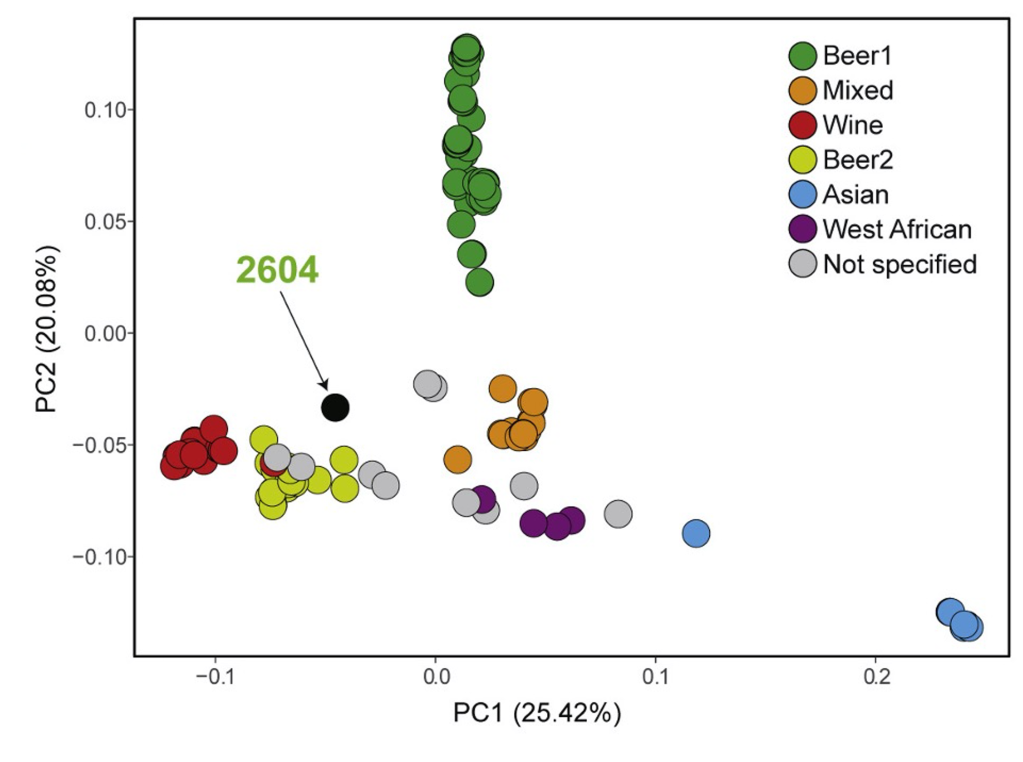
La proposta de que fossin S. cerevisiae de cerveses també lliga amb les anàlisis de la dieta, amb abundància de cereals, com en altres cultures i civilitzacions protohistòriques, com els sumeris i egipcis més o menys des del 3000 aC, força abans que aquestes mostres de les mines de sal.
Bé, tot plegat, aquest és un treball molt interessant que per un costat confirma que els humans elaboren aliments fermentats des de fa alguns milers d’anys, i per altre costat, demostra l’efectivitat dels mètodes moleculars més innovadors per identificar microorganismes de la microbiota, en aquest cas per la bona conservació de les mostres gràcies a la sal. Com sabeu, el protagonisme de la sal al llarg de la història li ha conferit un caràcter quasi sagrat i certament carregat de simbolisme.
Bibliografia
Cell Press (2021) “Ancient feces shows people in present-day Austria drank beer and ate blue cheese up to 2,700 years ago” Science Daily, 13 October. www.sciencedaily.com/releases/2021/10/211013114028.htm.
Maixner F, Sarhan MS, Huang KD, …. 15 ….., Zink KD, Reschreiter H, Kowarik K (2021) Hallstatt miners consumed blue cheese and beer during the Iron Age and retained a non-Westernized gut microbiome until the Baroque period. Current Biology 31, 1-14. https://doi.org/10.1016/j.cub.2021.09.031
Wong C (2021) “Ancient faeces show iron age miners ate blue cheese and drank beer”. New Scientist, 13 October. https://www.newscientist.com/article/2293434-ancient-faeces-show-iron-age-miners-ate-blue-cheese-and-drank-beer/
Wolbachia, el bacteri “feminista”, és eficaç contra el dengue i altres virus
15 agost 2021
Click here for the English version: Wolbachia, the feminist bacterium against dengue
QUI ÉS Wolbachia ?
Wolbachia és un gènere de bacteris endosimbionts (intracel·lulars) d’insectes i altres invertebrats que es va descobrir per estar implicat en el fenomen d’incompatibilitat citoplasmàtica, pel qual alguns encreuaments entre insectes infectats amb el bacteri donen distorsions de la ràtio de sexes o provoquen la mort de l’embrió. Encara que no es podien aïllar en medis de cultiu, l’amplificació amb PCR permeté seqüenciar els gens 16S rRNA i identificar-los com membres de l’ordre Rickettsiales dins el fílum alfa-proteobacteris (O’Neill et al. 1992). Tal com comentava en un altre post d’aquest mateix blog sobre els fílums bacterians, tots els bacteris d’aquest ordre, com també Rickettsia –patogen d’humans –, són endosimbionts obligats de cèl·lules eucariotes, i la relació filogenètica suggereix que els mitocondris –també endosimbionts– es van desenvolupar a partir d’aquest grup.
Com veiem (Figura 1, Figura 2), aquests Wolbachia són pleomòrfics, amb forma arrodonida predominant, de mida 0.2 a 4 micròmetres, residents en vacuoles de l’hoste. Són gram-negatius, amb un genoma aproximat de 1 Mb i uns 1000 gens (Taylor et al. 2018). El gènere Wolbachia fou identificat el 1925 per M. Hertig i S.B. Wolbach al mosquit comú Culex pipiens i ja el van descriure com a intracel·lular i que aparentment infectava només les gònades de l’insecte (Hertig & Wolbach 1924).
——————————————————————————————————-
Es troben Wolbachia en el 60% de les espècies d’insectes, i també en altres invertebrats, com aràcnids, nematodes, crustacis isòpodes i altres. De fet, és el bacteri paràsit més comú al món animal (LePage & Bordenstein 2013). L’espècie més comuna és W. pipientis, del qual actualment ja es disposa de la seqüència genòmica completa (Wu et al. 2004b). Sempre són endosimbionts, no es troben mai al medi ambient. Les interaccions amb l’hoste sovint són complexes i en algun cas són més mutualistes que paràsits (Taylor et al. 2018). Wolbachia es transmet a la descendència dels insectes sobretot verticalment per les femelles infectades. Algun cop pot ser transmesa horitzontalment, com s’ha vist en les vespes Trichogramma on es poden transmetre per contagi (Schilthuizen & Stouthamer 1997).
Des d’abans dels anys 1980s s’han descrit aquests bacteris com a “factors sexuals feminitzants” citoplasmàtics (Bull 1983) a diversos invertebrats, com insectes i crustacis isòpodes. D’aquests destaquen els treballs amb Armadillidium vulgare, els porquets de Sant Antoni o cochinillas, on Martin et al (1973) ja deien que aquests factors eren microorganismes, i després Rigaud & Juchault (1992) ja insinuaven que devien ser Wolbachia. Els bacteris feien que mascles es convertissin en femelles funcionals, que tenien descendència majoritàriament femenina. Els Wolbachia intracel·lulars alteren la biologia reproductiva de l’hoste animal de diverses maneres, com veurem tot seguit. Per tot això i com veieu al títol, sovint es fa l’acudit que Wolbachia és un bacteri “feminista” (Yong et al. 2016).
Els gens de Wolbachia també poden transmetre´s horitzontalment (TGH), per transducció, gràcies a un bacteriòfag. El fet que pugui haver-hi diverses soques de Wolbachia al mateix hoste permet l’intercanvi de gens entre elles mitjançant el fag (Kent et al. 2011). Aquest seria el primer cas de TGH detectat en un endosimbiont, fins i tot creuant barreres entre espècies, donant lloc a una distribució global en diversos hostes invertebrats. Tot plegat són fenòmens que contribueixen a l’evolució i per tant s’insinua que els Wolbachia són manipuladors de la biologia dels invertebrats (Werren et al 2008).
MÉTODES DE DIFERENCIACIÓ SEXUAL ALS HOSTES CAUSADA PER Wolbachia, INCLOENT LA FEMINITZACIÓ
Aquests bacteris poden infectar molt diversos òrgans, però les infeccions de les gònades són les que tenen més repercussió fenotípica. Als hostes que contenen Wolbachia, els bacteris són presents sempre als òvuls madurs però no a l’esperma. Per tant, només les femelles infectades són les que passen la infecció a la descendència. Wolbachia maximitza la seva propagació alterant significativament la capacitat reproductiva de l’hoste, de 4 maneres possibles:
1- Els mascles infectats moren durant el desenvolupament larvari, amb la qual cosa augmenta la proporció de femelles infectades. S’ha observat en coleòpters i lepidòpters (Hurst et al 1999).
2- Alguns mascles infectats es desenvolupen com femelles, hi ha feminització, com en alguns lepidòpters (Fujii et al 2001).
3- La partenogènesi, o sigui la reproducció de les femelles, infectades en aquest cas, sense mascles. També és una feminització o predomini de les femelles. Cada cop s’estan veien més casos de partenogènesi relacionats amb la presència de Wolbachia, amb la qual cosa fins i tot s’ha suggerit que aquest fenomen sempre seria atribuïble als bacteris (Tortora et al. 2007).
La partenogènesi dels himenòpters és de les més conegudes. Aquest ordre d’insectes (formigues, abelles, vespes, borinots i els símfits) tenen un sistema de determinació de sexe haplodiploïde. Alguns d’ells produeixen mascles haploides a partir d’ous no fertilitzats (arrenotòquia), una partenogènesi meiòtica. Però, a més en alguns himenòpters socials les reines o els individus obrers produeixen femelles diploides mitjançant telitòquia, una partenogènesi ameiòtica, on l’òvul haploide se segmenta sense fecundar. Òbviament, el control del sexe de la descendència és un factor clau en l’evolució de les estructurals colonials en aquests insectes socials (Pearcy 2004). La partenogènesi no és exclusiva d’himenòpters, ja que en tenen força altres insectes i altres animals (Wrensch & Ebbert 1993).
La partenogènesi causada per Wolbachia a la vespa Trichogramma ha estat força estudiada. El bacteri és al citoplasma dels òvuls de la vespa on indueix la duplicació dels gàmetes, donant lloc a una generació de tot femelles, o sigui és una completa partenogènesi, de tipus telitòquia (Schilthuizen & Stouthamer 1997, Huigens & Stouthamer 2003).
A més de Wolbachia, aquesta inducció de la partenogènesi també s’ha observat en Cardinium (Jeong & Stouthamer 2004), un altre bacteri gramnegatiu – un bacteroidetes en aquest cas– que parasita altres vespes, del gènere Encarsa (Zchori-Fein et al. 2004).
4- La incompatibilitat citoplasmàtica (IC o CI en anglès)
És la incapacitat dels mascles infectats per Wolbachia de reproduir-se amb femelles no infectades o infectades amb una altra soca del bacteri. A l’esquerra de la Figura 3 veiem que l’esperma no infectat pot fecundar tant òvuls infectats com els no infectats amb Wolbachia, i a la dreta veiem com l’esperma modificat per la infecció amb Wolbachia quan fecunda els òvuls que no contenen el bacteri, s’indueix la IC, i l’embrió mor i no arriba a terme.
Aquesta IC s’ha relacionat amb deficiències a la primera divisió mitòtica de l’embrió, amb errors a l’obertura de la membrana nuclear paterna, inestabilitat de les histones maternes sobre el DNA patern i replicació alentida d’aquest DNA, a més de defectes als cromosomes paterns (LePage & Bordenstein 2013).
Aquesta incompatibilitat unidireccional implica un clar augment a la descendència de femelles infectades amb Wolbachia, amb la qual cosa és un mecanisme de selecció positiva del bacteri. Tanmateix, aquest mecanisme de CI no influeix sobre el sexe de l’embrió.
Molts d’aquests efectes de diferenciació sexual, i sobretot la feminització i mort dels mascles poden portar a la formació de noves espècies. Per exemple, s’ha observat la pèrdua d’algun dels cromosomes sexuals, i també que les incompatibilitats degudes a la infecció amb diferents soques de Wolbachia poden afavorir la especiació dels hostes sense haver-hi barreres ecològiques o geogràfiques (Charlat 2003).
AVANTATGES DE LA “INFECCIÓ” AMB Wolbachia PER A L’HOSTE
A banda dels possibles efectes evolutius suara comentats, s’ha comprovat que alguns hostes es beneficien de la presència endosimbiòtica de Wolbachia. Per tant, encara que parlem de “infecció” i “paràsits”, la relació és sobretot mutualística.
Uns dels avantatges és la resistència viral trobada a Drosophila i a diversos mosquits, que quan són infectats amb Wolbachia són molt més resistents a virus RNA (Hedges et al. 2008), com veurem tot seguit. També s’ha observat que els bacteris ajuden a Drosophila en el metabolisme de ferro i algunes vitamines. En el cas dels nematodes com les filàries, sembla que Wolbachia li proporciona al cuc alguns compostos necessaris per a la seva reproducció (Foster et al. 2005).
Wolbachia PER COMBATRE VIRUS HUMANS
Hi ha força virus patògens d’humans que són transmesos per mosquits. Informalment els virus transmesos per artròpodes s’anomenen arbovirus (de arthropode-borne virus). Dels mosquits, Aedes aegypti és el que té més rellevància per ser el vector transmissor d’una sèrie de malalties víriques tropicals problemàtiques actualment, com el dengue, la febre groga, el zika, el chikungunya, el virus del Nil occidental o la mateixa malària. Moltes d’aquestes malalties d’arbovirus estan molt poc controlades i els virus causants són patògens emergents o reemergents que produeixen malalties importants i epidèmies per tot el món (Conway et al. 2014). Les causes són sobretot l’augment de població i de mobilitat, la urbanització i la pèrdua d’àrees forestals. Per exemple, el nombre de casos simptomàtics de dengue s’ha doblat els darrers 10 anys, la meitat dels humans viuen en àrees endèmiques de dengue i s’estima que cada any hi ha un total de 390 milions de noves infeccions i uns 13000 morts més. Aquest escenari quasi pandèmic ha portat a la OMS designar el dengue com una de les 10 principals amenaces de la salut mundial (Gil Ferreira et al. 2020).
Actualment, la majoria d’estratègies de control dels arbovirus es basen en insecticides i en reduir els ambients on prosperen els mosquits vectors, o bé en tractaments simptomàtics no específics de les malalties ja que en la majoria d’aquests casos encara no hi ha vacunes assequibles. Tanmateix, els insecticides no són específics, causen toxicitat ambiental i indueixen la resistència a aquests compostos. Calen estratègies més efectives i sostenibles urgentment (Gil Ferreira et al. 2020), i aquí és on entra Wolbachia.
Com hem vist, característiques de Wolbachia com la incompatibilitat citoplasmàtica la fan útil per promoure derives genètiques a una població d’insectes. El fet que les femelles infectades amb Wolbachia produeixen descendència tant de mascles infectats com dels no-infectats mentre que les femelles no infectades només puguin tenir descendents amb mascles no infectats dona lloc a un avantatge reproductiu per a les infectades que fa augmentar ràpidament la presència de Wolbachia (Hancock et al. 2011).
Molts mosquits, incloses algunes de les principals espècies transmissores de malalties, porten Wolbachia. Per exemple, l’esmentat mosquit comú Culex pipiens i altres, porten soques d’aquest bacteri. Però en canvi, Aedes aegypti i altres espècies considerades importants en la transmissió de patògens humans gairebé no tenen Wolbachia de forma natural (Moreira et al. 2009).
Per això, s’hi va treballar i es va aconseguir amb èxit, la transfecció de Wolbachia als mosquits Aedes mitjançant tècnica de microinjecció al laboratori, tant en el mosquit tigre Ae. albopictus (Xi et al. 2005), com per a Ae. aegypti (McMeniman et al. 2009).
L’avenç important va esdevenir tot seguit quan es va descobrir que aquests Wolbachia transferits promovien una interferència amb els virus patògens humans transmesos pels mosquits. En efecte, es va demostrar el bloqueig de replicació dels virus del dengue, Zika, febre groga i virus Mayayo (Moreira et al. 2009). Els mecanismes d’aquest bloqueig sembla que són diversos, com una major producció d’espècies reactives d’oxigen (ROS) i la competència pels recursos cel·lulars –com el colesterol– entre Wolbachia i els virus. A més a més, s’ha observat que el bacteri estimula el sistema immune del mosquit impedint les infeccions víriques, amb la qual cosa el nombre de mosquits transmissors als humans és menor (Moreira et al. 2009, Gil Ferreira et al. 2020).
S’han aplicat diverses estratègies d’introducció dels Aedes infectats amb Wolbachia en poblacions on hi ha els virus, i la que està funcionant millor és alliberar un nombre relativament reduït de mosquits portadors de Wolbachia, tant mascles com femelles, a la natura. El nombre d’aquests mosquits va creixent i van passant els bacteris a la població silvestre de mosquits mitjançant el mecanisme d’incompatibilitat citoplasmàtica, i arriben a ser majoria en pocs mesos (Figura 4).
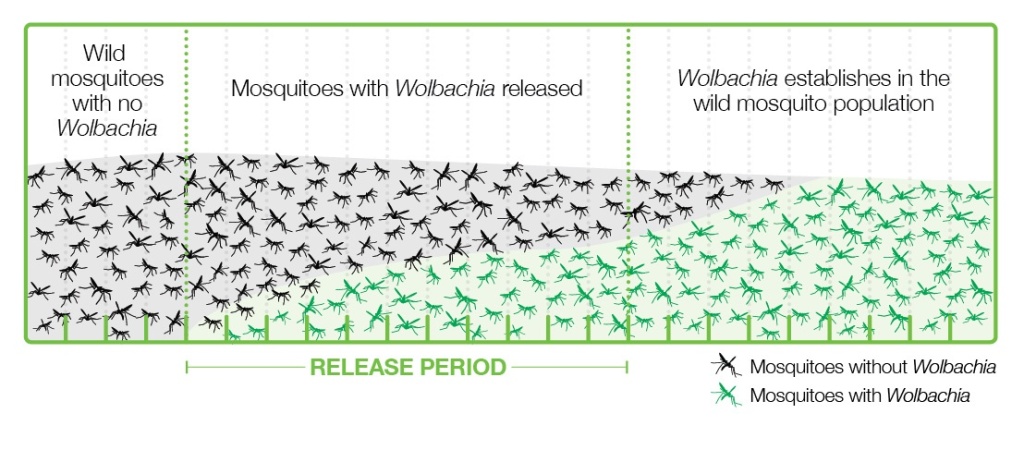
Aquesta estratègia té els avantatges d’utilitzar mètodes naturals, no és gaire costosa, és fàcil de portar a terme, i és sostenible, ja que un cop els mosquits infectats són majoria es mantenen sense intervenció humana. Aquesta estratègia està en línia amb l’Agenda 2030 de Desenvolupament Sostenible de l’ONU (Gil Ferreira et al. 2020).
En l’aplicació d’aquesta estratègia amb Wolbachia i els mosquits cal destacar el World Mosquito Program (2021), que s’inicià el 2004 gràcies a la Fundació Bill & Melinda Gates i a la Fundació del NIH dels USA. El 2011 es van començar les primeres proves de camp a Cairns, al Nord d’Austràlia. S’hi van anar introduint tandes d’ous de mosquits amb la col·laboració dels membres de la comunitat, durant 10 setmanes, aconseguint taxes exitoses de mosquits-Wolbachia de més del 90% (World mosquito Program / Our story). Això va anar aparellat amb una quasi pràctica desaparició de la malaltia del dengue (Figura 5, 1a columna esquerra) i la proporció de mosquits-Wolbachia s’ha mantingut estable durant 8 anys (Gil Ferreira et al. 2020). Posteriorment el WMP s’ha anat estenent a Malàisia (Wolbadmin 2021), Indonèsia (Olazo 2021), Vietnam i altres països amb presència de dengue i s’ha comprovat que l’estratègia funciona molt bé (Figura 5).
Aquest està essent un dels exemples més exitosos de com un vector, el mosquit, pot ser utilitzat com un aliat per combatre els arbovirus (Gil Ferreira et al. 2020).
D’altra banda, en el cas dels nematodes que contenen Wolbachia com les filàries, que provoquen les filariosis, malalties tropicals humanes i d’altres animals domèstics, la solució està essent el tractament amb antibiòtics com doxiciclina o altres que inhibeixen el bacteri, amb la qual cosa excepcionalment s’empra un antibiòtic per combatre un paràsit invertebrat (Fundación iO 2021, Taylor et al. 2018).
BIBLIOGRAFIA
Bull JJ (1983) Evolution of Sex Determining Mechanisms. Benjamin/CummingS Publ. Co., Menlo Park, CA, USA.
Charlat S (2003) Evolutionary consequences of Wolbachia infections. Trends in Genetics 19(4):217–23
Conway MJ, Colpitts TM, Fikrig E (2014) Role of the Vector in Arbovirus Transmission. Annual Review of Virology 1:1,71-88
Foster J, Ganatra M, Kamal I, et al. (2005) The Wolbachia Genome of Brugia malayi: Endosymbiont Evolution within a Human Pathogenic Nematode. PLOS Biology 3(4): e121.
Fundación iO (2021, August 12) Enfermedades: Wolbachia. Fundación iO. Retrieved from https://fundacionio.com/salud-io/enfermedades/wolbachia/
Fujii Y, Kageyama D, Hoshizaki S, Ishikawa H, Sasaki T (2001) Transfection of Wolbachia in Lepidoptera: the feminizer of the adzuki bean borer Ostrinia scapulalis causes male killing in the Mediterranean flour moth Ephestia kuehniella. Proceedings of the Royal Society of London B: Biological Sciences 268(1469): 855–859.
Gil Ferreira A, Fairlie S, Luciano Moreira LA (2020) Insect vectors endosymbionts as solutions against diseases. Curr Opinion in Insect Sci 40, 56-61.
Hancock PA, Sinkins SP, Godfray HC (2011) Strategies for introducing Wolbachia to reduce transmission of mosquito-borne diseases. PLOS Negl. Trop. Dis. 5(4): e1024.
Hedges L, Brownlie J, O’Neill S, Johnson, K (2008) Wolbachia and Virus Protection in Insects. Science 322(5902):702
Hertig M, Wolbach SB (1924) Studies on Rickettsia-Like Micro-Organisms in Insects. Journal of Medical Research44(3):329-374.
Huigens ME, Stouthamer R (2003). Parthenogenesis associated with Wolbachia. In: Bourtzis K, Miller TA (eds) Insect Symbiosis. CRC Press: Boca Raton, FL, pp 247–266.
Hurst G, Jiggins FM, Graf von der Schulenburg JH, Bertrand D et al. (1999) Male killing Wolbachia in two species of insects. Proceedings of the Royal Society B 266 (1420): 735-740.
Jeong G, Stouthamer R (2004) Genetics of female functional virginity in the Parthenogenesis-Wolbachia infected parasitoid wasp Telenomus nawai (Hymenoptera: Scelionidae). Heredity 94 (4): 402–407.
Kent BN, Salichos L, Gibbons JG, et al. (2011) Complete Bacteriophage Transfer in a Bacterial Endosymbiont (Wolbachia) Determined by Targeted Genome Capture. Genome Biology and Evolution 3:209–218
LePage D, Bordenstein SR (2013) Wolbachia: can we save lives with a great pandemic ? Trends in Parasitology 29, 385-393.
Martin G, Juchault P, Legrand JJ (1973) Mise en evidence d’un micro-organisme intracytoplasmique symbiote de l’oniscoïde Armadillidium vulgare Latr. dont la presence accompagne l’intersexualite ou la feminisation totale des males genetiques de la lignee thelygene. C.R. Acad. Sci. Paris, 276,2312—2316.
McMeniman CJ, Lane RV, Cass BN et al. (2009) Stable introduction of a life-shortening Wolbachia infection into the mosquito Aedes aegypti. Science 323:141-144
Moreira LA, Iturbe-Ormaetxe I, Jeffery Ja, Lu G, Pyke AT, Hedges LM, Rocha BC, Hall-Mendelin S, Day A, Riegler M et al. (2009) A Wolbachia symbiont in Aedes aegypti limits infection with dengue, chikungunya, and plasmodium. Cell139:1268- 1278.
Moronta F (2021 August 12) La bacteria Wolbachia puede frenar la expansión del Zika. Félix-Moronta-Blog, 06/05/2016. Retrieved from http://felixmoronta.pro/wolbachia-zika/
Olazo A (2021, June 15). Wolbachia, la bacteria que infecta mosquitos y reduce la transmisión del dengue en un 77%. Robotitus. Retrieved from https://www.robotitus.com/wolbachia-la-bacteria-que-infecta-mosquitos-y-reduce-la-transmision-del-dengue-en-un-77
O’Neill SL, Giordano R, Colbert AME, Karr TL, Robertson HM (1992) 16S rRNA phylogenetic analysis of the bacterial endosymbionts associated with cytoplasmic incompatibility. Proc Natl Acad Sci USA 89, 2699-2702.
Pearcy, M. (2004). Conditional Use of Sex and Parthenogenesis for Worker and Queen Production in Ants. Science 306(5702): 1780–1783.
Rigaud T, Juchault P (1992) Genetic control of the vertical transmission of a cytoplasmic sex factor in Armadillidium vulgare Latr. (Crustacea, Oniscidea). Heredity 68, 47-52
Schilthuizen MO, Stouthamer R (1997) Horizontal transmission of parthenogenesis-inducing microbes in Trichogramma wasps. Proc. R. Soc. Lond. B Biol. Sci., 264, 361-366.
Taylor MJ, Bordenstein SR, Slatko B (2018) Microbe Profile: Wolbachia: a sex selector, a viral protector and a target to treat filarial nematodes. Microbiology 164(11):1345–1347
Tortora GJ, Funke BR, Case CL (2007) Microbiology: an introduction. Pearson Benjamin Cummings.
Werren JH, Baldo L, Clark ME (2008) Wolbachia: master manipulators of invertebrate biology. Nature Reviews Microbiology 6, 741-751.
Wikipedia (2021 August 12). Wolbachia. Wikimedia Foundation. Retrieved from https://en.wikipedia.org/wiki/Wolbachia
Wolbadmin (2021 August 12). What is Wolbachia. Wolbachia Malaysia. Retrieved from https://www.imr.gov.my/wolbachia/2021/05/25/what-is-wolbachia/
World Mosquito Programm (2021 August 12). The World Mosquito Program’s Wolbachia Method. World Mosquito Program. Retrieved from https://www.worldmosquitoprogram.org
Wrensch DL, Ebbert MA (1993) Evolution and Diversity of Sex Ratio in Insects and Mites. Chapman & Hall: New York and London.
Wu M et al. (2004a) Genome Sequence of the Intracellular Bacterium Wolbachia. PLoS Biology 2(3): e76.
Wu M, Sun LV, Vamathevan J, Riegler M, Deboy R et al. (2004b) Phylogenomics of the Reproductive Parasite Wolbachia pipientis wMel: A Streamlined Genome Overrun by Mobile Genetic Elements. PLoS Biology 2(3): e69.
Xi Z, Dean JL, Khoo C, Dobson SL (2005) Generation of a novel Wolbachia infection in Aedes albopictus (Asian tiger mosquito) via embryonic microinjection. Insect Biochem Mol Biol 35:903-910
Yong E (2016) I Contain Multitudes: The microbes within us a grander view of life. Ed. Penguin Random House, New York USA
Zchori-Fein E, Perlman SJ, Kelly SE, Katzir N, Hunter MS (2004). Characterization of a ‘Bacteroidetes’ symbiont inEncarsia wasps (Hymenoptera: Aphelinidae): proposal of ‘Candidatus Cardinium hertigii’. Int J Syst Evol Microbiol 54: 961–968.
Zhukova M, Voronin D, Kiseleva EV (2008) High temperature initiates changes in Wolbachia ultrastructure in ovaries and early embryos of Drosophila melanogaster. Cell and Tissue Biology 2:546-556.