Category Archives: Bacteris Làctics i productes
El cervell humà es va desenvolupar gràcies als aliments fermentats
19 gener 2024
Click here for the English version: Human brain developed thanks to fermented food
Estic subscrit, entre altres mitjans digitals, a Science Alert, un newsletter —butlletí informatiu— científic gratuït, en el qual cada setmana trobo alguna notícia interessant. Fa poques setmanes em va sorprendre molt especialment una notícia (Dyer R (2023) sobre aquesta hipòtesi del títol, la qual trobo molt versemblant. A banda d’aquesta notícia-resum, per conèixer-ne millor els detalls vaig anar a l’article original de Bryant et al. “Fermentation technology as a driver of human brain expansion”, que us comento a continuació, junt amb altres coses relacionades.
CERVELL MÉS GRAN
La principal característica diferencial dels humans respecte als altres primats i animals en general, és el cervell més gran i complex. Com que quan més gran és un animal, major és el pes de l’encèfal, s’utilitza una mesura relativa que és el quocient d’encefalització (EQ), que és la relació entre la massa de l’encèfal i l’esperada per a un animal típic de les mateixes dimensions. L’EQ de Homo sapiens és al voltant de 7.5, mentre que per a altres primats és entre 2 i 3, i altres mamífers com el gos és entre 1 i 2, excepte els cetacis com orques o dofins, que tenen 3 o 4.
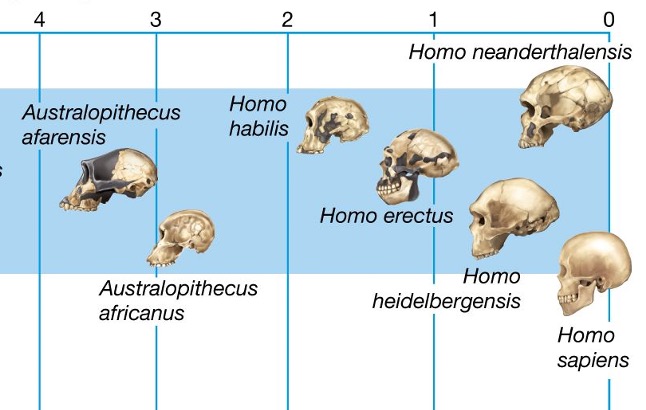
Per tant, el cervell humà va més que triplicar la seva grandària respecte a altres primats en la seva evolució des dels darrers australopitecs —que ja eren bípedes, i per tant tenien les mans lliures— fa uns 2.5 milions d’anys (Ma) fins als primers Homo aproximadament mig milió d’anys després. Els australopitecs tenien un volum endocranial (ECV) de 400 mL (Figura 1), mentre que per a Homo erectus (Figura 2) era d’uns 800 mL, i després l’expansió del cervell va continuar amb l’emergència de H. sapiens i prèviament amb H. neanderthalensis, ambdós amb uns 1500 mL (Miller et al. 2019; Ponce de León et al. 2021). Òbviament aquest engrandiment del cervell i sobretot del còrtex frontal va determinar l’augment de les capacitats de raonament, reflexió, adaptació, socialització i d’altres habilitats, o sigui del desenvolupament de la intel·ligència humana.

MÉS CERVELL i MENYS BUDELLS
Hi ha diverses teories sobre els mecanismes que haurien afavorit aquesta accelerada expansió del cervell. El factor limitant en l’engrandiment és la disponibilitat de recursos calòrics, perquè el cervell té una alta despesa metabòlica, comparada amb la majoria d’altres teixits. La taxa metabòlica en repòs del cervell suposa el 22% de la del cos humà (McClave & Snider 2001).
Les mutacions que van portar a un augment de mida del cervell, encara que tindrien uns clars beneficis finals, no serien adaptatives si comportaven un major risc de fam. Una reducció en la quantitat de teixit intestinal, que té unes necessitats metabòliques similars a les del cervell, alliberaria calories necessàries per a la digestió per tal de reassignar-les al cervell. Això es confirma pel fet que la mida del còlon dels humans és la quarta part del corresponent a primats de la nostra talla (Taula 1), mentre que el cervell dels H. sapiens actuals és quasi el triple del que correspondria.
Taula 1. Masses esperades d’alguns òrgans humans basades en els valors dels grans simis en comparació amb les reals d’un humà occidental actual de 65 kg (Adaptat de Bryant et al 2023).
| Òrgan | Massa esperada (kg) | Massa real (kg) | Real / esperada |
| Cor | 0.32 | 0.30 | 0.94 |
| Fetge | 0.24 | 0.30 | 1.25 |
| Budell prim | 0.40 | 0.62 | 1.55 |
| Còlon | 0.85 | 0.22 | 0.26 |
| Cervell | 0.45 | 1.30 | 2.89 |
CANVIS DE DIETA
Tanmateix, la reducció intestinal havia d’anar acompanyada d’un canvi a la dieta, amb aliments més fàcils de digerir i més energètics. Els homínids precursors d’Homo haurien passat d’un règim herbívor-frugívor a un omnívor-carnívor. Les hipòtesis actuals apunten als dos canvis següents, força coneguts i bastant versemblants:
1) El major consum de carn —de proteïna animal en general— s’ha argumentat com un dels elements clau en l’evolució humana. La dieta de H. sapiens és clarament més carnívora que els altres primats parents, i per tant la cacera d’altres animals hauria d’haver estat un hàbit creixent als precursors de Homo (Mann 2000). Tanmateix, un punt feble d’aquesta hipòtesi és que sembla que la caça era poc important inicialment, fa 1-2 Ma, ja que aquests primers Homo i els seus precursors eren sobretot recol·lectors, i la cacera es desenvolupà plenament força després, a finals del paleolític inferior —com a molt fa uns 500.000 anys—, en paral·lel al desenvolupament de les primeres armes prehistòriques (Bryant et al. 2023).
En canvi, sembla que el consum de carronya deixada per altres animals carnívors fou anterior a la cacera, des del final del pliocè o inicis del plistocè fa uns 3 Ma. Una alternativa relacionada amb la necrofàgia però més profitosa per consumir carn és prendre les preses caçades per altres animals. De fet, els registres arqueològics demostren que aquesta darrera opció per obtenir carn fresca era predominant sobre la de ser carronyaires passius, on el rendiment de consum càrnic és més baix (Bunn & Ezzo 1993).
Però el consum de proteïna animal d’alt valor nutritiu no es limita a la carn de mamífers i aus: cal tenir en compte la pesca i sobretot la recol·lecció de marisc. Aquest darrer cas té l’avantatge arqueològic d’haver-se trobat molts llocs amb closquers —acumulació de closques de mol·luscs— que indiquen la gran explotació d’aquest recurs proteic que els humans han fet de fa temps. Els closquers trobats més antics són els de Pinnacle Point a Sudàfrica fa 160.000 anys, molt importants perquè junt amb altres restes són una de les evidències dels primers Homo sapiens (Marean et al. 2007), però és clar, són certament posteriors al desenvolupament del cervell.
2) La domesticació del foc i la conseqüent possibilitat de cuinar els aliments va ser un altre element crucial per obtenir més substrats calòrics biodisponibles i digerir-los més fàcilment, tant a nivell de masticació mecànica com de despesa energètica necessària al tracte digestiu. Això és molt evident en el consum de carn comentat, tant fresca com de carronya, i a més en aquest cas per mitigar la contaminació microbiana. A més a més el cuinat també va ser molt important en permetre la ingestió d’aliments vegetals i sobretot dels tubercles, òrgans de reserva soterranis molt rics en carbohidrats, però que no són directament digeribles i/o contenen compostos tòxics si no es couen (Wrangham et al. 1999).
Tanmateix, no hi ha evidències arqueològiques clares de què els australopitecs o els primers Homo dominessin el foc, i les primeres evidències serien per als H. erectus entre 1 i 1.5 Ma (Hlubik et al. 2019) però més clarament de fa 800.000 anys (Goren-Inbar et al 2004). Per tant, el ple domini del foc hauria estat posterior a l’inici del desenvolupament del cervell. De fet, l’expertesa del foc requereix la capacitat cognitiva de planejar, crear, mantenir i usar el foc efectivament, o sigui, un cervell més desenvolupat que el dels australopitecs (Bryant et al. 2023).
HIPÒTESI DE LA FERMENTACIÓ EXTERNA dels aliments, en contrast amb l’habitual “INTERNA”
Els autors del treball (Bryant et al. 2023) proposen aquest terme d’externa per diferenciar-lo de la fermentació interna que és la realitzada per la microbiota del tracte gastrointestinal humà en la digestió. La idea és que l’externalització d’aquesta fermentació interna va alliberar requeriments energètics corporals que van permetre l’expansió cerebral.
Cal recordar que aquí s’utilitza el terme “fermentació” en la seva accepció més general de transformació de compostos orgànics per part de microorganismes, mentre que l’accepció original del concepte “fermentació” en sentit bioquímic estrictament és el tipus de metabolisme heteròtrof anaeròbic on font d’energia i carboni són compostos orgànics i l’acceptor d’electrons són aquests mateixos compostos. La majoria de fermentacions d’aliments com la làctica o alcohòlica són d’aquesta accepció bioquímicament parlant, però altres processos de transformació microbiana que incloem a més d’aquestes quan es parla de “fermentació” en general, són d’altres tipus de metabolisme, com per exemple degradacions aeròbiques o altres reaccions. Podeu veure més informació sobre els aliments fermentats al meu post “Aliments fermentats: consens recent sobre aquest concepte” (Figura 3).

Encara que no és usual anomenar-ho així, la digestió que té lloc al tracte gastrointestinal humà o d’altres animals inclou aquesta “fermentació interna”, entenent com a tal la intervenció microbiana, o sigui el conjunt de transformacions que hi realitzen els microorganismes, la microbiota intestinal, sobretot al còlon. La digestió d’una part important dels components fibrosos vegetals requereix aquesta fermentació interna per part de la microbiota. Als remugants això s’aconsegueix a més amb estómacs addicionals i una microbiota cel·lulolítica abundant. Als altres animals no remugants, inclosos els primats, tenim un còlon i un cec més desenvolupats, i una major àrea per a l’absorció dels nutrients. El còlon dels humans i molts primats conté uns 10^12 microbis per mL i el trànsit per aquest budell gros és d’unes 20-40 hores, mentre que al prim només és 2-4 h. Cada cop és més clara la rellevància de la microbiota del còlon per a la salut, en quant a l’absorció de nutrients, la regulació energètica i un sistema immune correcte (O’Hara & Shanahan 2006).
La fibra soluble, sobretot oligosacàrids, és fermentada per la microbiota produint sobretot àcids grassos de cadena curta (SCFA), que aporten unes 2 cal/g de fibra, que suposa un 50% addicional a les 4 cal/g disponibles per la digestió directa dels carbohidrats fàcils (midó, sucres). Aquestes 2 cal/g són un 2-10% de l’energia total que la dieta ens proporciona, que és molt poca comparada amb altres mamífers (Taula 2). Aquests SCFA són sobretot acetat, propionat i butirat. L’acetat s’utilitza per sintetitzar colesterol i altres SCFA i proporciona energia al cor, ronyons i múscul; el propionat és precursor de la síntesi hepàtica de glucosa i proteïnes; i el butirat és la font d’energia preferida dels colonòcits.
Taula 2. Energia derivada dels àcids grassos de cadena curta (SCFA) produïts per la fermentació de la microbiota intestinal
| Espècie | Dieta | % Energia del total digerit |
| Bou / vaca | Herbívor remugant | 72 |
| Ovella | Herbívor remugant | 84 |
| Conill | Herbívor monogàstric | 32 |
| Castor | Herbívor monogàstric | 19 |
| Porc espí | Herbívor monogàstric | 16 |
| Porc | Omnívor | 36 |
| Aluata, mico udolador | Herbívor monogàstric | 30 |
| Goril·la | Herbívor monogàstric | 57 |
| Homo sapiens | Omnívor | 2-10 |
A banda dels SCFA, els nutrients principals produïts per la microbiota són les vitamines del complex B i la K, que són absorbides per l’intestí. A més, la microbiota augmenta la biodisponibilitat de micronutrients minerals mitjançant la degradació de factors antinutricionals com els fitats i oxalats —presents a molts vegetals— que formen complexos amb els cations (Fe, Zn, Mg, Ca, …) i prevenen la seva absorció.
La fermentació externa dels aliments que van començar a fer els primers humans té unes funcions similars a la interna com l’augment de la biodisponibilitat i absorció de macronutrients i micronutrients. Amb això, s’augmenta la digestibilitat de carbohidrats i proteïnes, per exemple als llegums hidrolitzant les macromolècules a aminoàcids i sucres més digeribles. La fermentació de carbohidrats també fa augmentar les vitamines B disponibles en un ordre de magnitud (Sandhu et al 2017). I els comentats fitats i oxalats poden ser degradats per la fitasa que produeixen bacteris làctics de les fermentacions externes, amb la qual cosa augmenta l’absorció de minerals. Aquesta eliminació del fitat fins i tot és més efectiva fermentant que per cocció, ja que amb aquesta baixa l’activitat de la fitasa per damunt de 80ºC.
Un gran benefici de la fermentació externa és que pot fer que aliments tòxics ho deixin de ser. El cas més conegut és la destoxificació dels glicòsids cianogènics de la mandioca (o iuca o cassava), un aliment bàsic de milions de persones a les zones tropicals. Si no es fermenta, aquests glicòsids són hidrolitzats pels microbis del còlon produint el tòxic cianur. Quan es fermenta adientment els bacteris làctics trenquen les parets cel·lulars dels tubercles i permeten la hidròlisi de la toxina, afavorida també per l’àcid làctic que produeixen (Padmaja & Steinkraus 1995).
A més a més, la fermentació externa dels aliments contribueix a una millor eficàcia de la microbiota intestinal en la digestió. En primer lloc, part de la microbiota ingerida amb l’aliment fermentat pot colonitzar l’intestí, contribuint a la seva biodiversitat, augmentant la capacitat de fermentar més nutrients, i afavorint que alguns microbis endògens produeixin bacteriocines contra possibles patògens. S’ha vist que aquests beneficis també són possibles encara que els microbis de l’aliment fermentat només tinguin un contacte transitori amb els bacteris residents (Ohland & MacNaughton 2010). Amb això, la fermentació externa pot ajudar a la microbiota endògena a protegir l’hoste d’infeccions i malalties, ja que una microbiota correcta produint quantitat de SCFA a partir de la fermentació de carbohidrats no digeribles està ben relacionada amb una reducció dels desordres gastrointestinals (Alexander et al 2019).
FERMENTACIÓ EXTERNA d’ALIMENTS, IMPULSORA DE L’EXPANSIÓ DEL CERVELL HUMÀ
Com hem vist abans, sembla que els canvis de dieta des dels australopitecs als humans, com el major consum de carn o d’aliments cuinats amb el domini del foc, són relativament posteriors a l’expansió del cervell, i només amb aquests canvis no s’acaba d’explicar el ràpid desenvolupament del cervell, simultània a la reducció del còlon i el desplaçament de gran despesa energètica de l’intestí al cervell.
Per als inicis de la fermentació externa d’aliments no caldria tenir una gran capacitat de raonament. Els australopitecs ja tenien algunes eines senzilles que podrien utilitzar per escorxar animals capturats o de la carronya, i podrien transportar aquests aliments fins a l’habitatge, fos cova o balma o refugis temporals, gràcies al bipedisme ja desenvolupat. També podrien transportar fruits, tubercles i altres aliments potencials. Encara que per exemple els ximpanzés ocasionalment poden transportar eines temporals o les restes d’animals caçats, ho fan en distàncies curtes, d’uns centenars de metres com a molt, i la majoria dels aliments els consumeixen al lloc de captura.
Un cop al lloc d’habitatge, aquests primers Homo devien deixar el menjar per anar-lo consumint i acumulant-ne més del capturat. La reutilització de lloc d’emmagatzematge hauria promogut un ecosistema microbià que conduís a la fermentació. Els aliments novament incorporats haurien estat inoculats amb els ja presents al lloc, o al cos dels mateixos homínids, les mans per exemple. Aquesta pràctica transmesa socialment de reutilitzar llocs, contenidors o eines per manipular els aliments hauria anat promovent les fermentacions i l’estabilitat dels agents microbians fermentatius. Com en tot procés de selecció, aquesta tecnologia primitiva s’hauria anat modificant, sobretot aprenent a no consumir els productes fets malbé amb patògens o compostos tòxics, segurament amb més d’una víctima pel camí.
La fermentació externa dels aliments requereix pocs coneixements, força menys que la utilització del foc, ja que la fermentació és un procés natural que pot passar espontàniament, és un procés passiu per al qual no cal un esforç actiu com el de mantenir el foc. I a més, la fermentació pot preservar els aliments durant molt de temps, anys i tot, gràcies sobretot a alguns productes de la fermentació com l’àcid làctic o l’etanol.
De fet, es proposa que altres espècies de Homo com els Neandertals ja deixaven fermentar carn, amb la qual cosa la baixada de pH degut a l’àcid produït preservava la vitamina C continguda a la carn i així evitaven l’escorbut (Speth 2019).
Segurament la fermentació s’aniria combinant amb altres tècniques de conservació com el fumat, assecat i salat, com es fa actualment. Però la facilitat de la fermentació en molt diversos tipus d’aliments, ambients i condicions devia permetre la seva difusió. La prova més evident és que en l’actualitat hi ha múltiples aliments fermentats, a pràcticament totes les parts del món. Es calcula que hi ha més de 5000 varietats d’aliments fermentats, que segons la FAO són el 35% del mercat actual de tots els aliments. En veiem alguns a la Taula 3 i a la Figura 4. També podem veure una selecció de 36 d’ells a un lloc web d’informació gastronòmica: howtocook.recipes.
Taula 3. Relació d’aliments fermentats, ordenats pels tipus de substrat: parts de vegetals o animals (modificada i ampliada de Bryant et al 2023).
| Nom producte | Substrat | Tipus producte | Lloc d’origen | Microorganismes |
| Kimchi | fulles de col, rave i altres | àcid | Àsia E | Bacteris làctics (BL) |
| Xucrut | fulles de col | àcid | Europa | BL, enterobacteris |
| Pu-erh | fulles de té | àcid, beguda | Àsia E | Floridures, llevats |
| Kombutxa de té | fulles de té | àcid, beguda | Àsia E | Bacteris acètics, llevats |
| Pàmpols per a dolmades | fulles de raïm | àcid | Europa SE | BL |
| Gundruk | fulles de raves, col i altres | àcid | Nepal | BL |
| Sinki | arrel de rave | àcid | Nepal | BL |
| Garri | arrel de mandioca | àcid | Àfrica W | BL, floridures, llevats |
| Sapal | tubercle de taro | àcid | Papua Nova Guinea | BL, llevats |
| Poi | tubercle de taro | àcid | Hawaii | BL |
| Tocosh | patata | àcid | Amèrica S | BL |
| Fufu | arrels de nyam, mandioca | àcid | Àfrica W | BL |
| Natto, Kinema i altres | faves de soia | àlcali | Japó, Àsia E | Bacillus subtilis (més info al meu post) |
| Salsa Gochujang | pebre, arròs, soja, cereals | àcid + dolç picant, condiment | Corea | Bacillus, Enterococcus, cianobacteri Aerosakkonema, floridures |
| Tempeh | faves de soia | àlcali | Indonèsia | Rhizopus |
| Salsa de soia | faves de soia | àlcali + àcid, condiment | Àsia E | Aspergillus oryzae (koji), BL, llevats |
| Miso | faves de soia, cereals | àlcali + àcid, condiment | Japó | Aspergillus oryzae (koji), BL, llevats |
| Oncom | restes de soia, mandioca i altres | àlcali | Indonèsia | Rhizopus, Neurospora |
| Sumbala, Dawadawa | grans de fabàcia néré | àlcali | Àfrica W | Bacillus, BL |
| Café (més info al meu post) | grans de cafè | àcid, beguda | Àfrica E | Enterobacteris, Bacillus, BL i llevats |
| Cacau | grans de cacau | àcid | Amèrica central i S | Llevats, BL i bacteris acètics |
| Olives de taula | fruits | àcid | Mediterrani | BL, llevats |
| Altres vegetals confitats | cogombres, albergínies, raves i altres | àcid | Mediterrani | BL, bacteris acètics |
| Pulque | saba de tija floral del maguei, Agave | alcohol, beguda | Mèxic | Zymomonas, BL, llevats |
| Vi | fruits de raïm | alcohol, beguda | Mediterrani | Llevats, i BL a malolàctica |
| Sidra | poma | alcohol, beguda | Europa W | Llevats |
| Sidra de pera | pera | alcohol, beguda | Regne Unit, França | Llevats |
| Vins de fruita | fruites diverses: cirera, banana i altres | alcohol, beguda | Europa N, Amèrica central | Llevats |
| Vinagre | fruites o cereals | àcid, condiment | Mediterrani | Bacteris acètics |
| Cerveses | grans de cereals | alcohol, beguda | Europa, Àsia W | Llevats |
| Cerveses “àcides”(més info al meu post) | grans de cereals | alcohol + àcid, beguda | Bèlgica, Alemanya | Llevats, BL |
| Kvass | grans de cereals | alcohol + àcid, beguda | Europa E | Llevats, BL |
| Sake, vi d’arròs | grans d’arròs | alcohol, beguda | Japó | Llevats, Aspergillus oryzae (koji) |
| Makgeolli, vi d’arròs coreà | grans de cereals | alcohol, beguda | Corea | Llevats, Aspergillus, BL, proteobacteris |
| Chicha | grans de moresc | alcohol, beguda | Amèrica S | BL, altres bacteris, llevats |
| Massa mare, sourdough | grans de cereals | àcid, massa | Europa, Àsia W, Amèrica N | BL, llevats |
| Appam | arròs, llet coco | àcid, massa | Índia | BL, llevats |
| Idli | arròs i llenties | àcid | Índia | BL |
| Kenkey | grans de moresc | àcid, massa | Àfrica W | BL, llevats |
| Pozol | grans de moresc, cacau | àcid, beguda | Amèrica central | BL, altres bacteris, llevats, floridures |
| Injera | grans de cereals (Eragrostis tef) | àcid, pa | Etiòpia, Àfrica E | BL, Bacillus, enterobacteris, llevats |
| Hidromel, Tej etíop | mel | alcohol, beguda | Àfrica, Àsia, Europa | Llevats |
| Formatges | llet | àcid | Mundial | BL, altres bacteris, llevats, floridures |
| Iogurt i semblants | llet | àcid | Europa E, Àsia W | BL |
| Crème fraiche | llet | àcid | França, Europa | BL |
| Quefir | llet | àcid | Caucas | BL, llevats |
| Kumis | llet d’euga | àcid, alcohol | Àsia central, Amèrica S | BL, llevats |
| Chal | llet de camella | àcid | Àsia central | BL, llevats |
| Leben | llet | àcid | Àfrica N, Àsia W | BL |
| Buttermilk | sèrum de mantega | àcid | Europa, Àsia W | BL |
| Embotits | carn de porc i altres | àcid | Europa | BL, llevats, floridures |
| Pernil | carn de porc | àcid | Europa | BL, altres bacteris, floridures |
| Nem chua | carn de porc, arròs, fulles plàtan | agredolç | Vietnam | BL |
| Satchu | carn | àcid | Himàlaia | BL, altres bacteris, llevats, floridures |
| Pemmican | carn de bisó, cèrvol i altres | àcid | Amèrica N | Diversos bacteris |
| Dodery | ossos animals | àcid | Sudan | Bacillus, altres bacteris, BL, llevats |
| Tiroi | musclos, altre marisc | àcid | Nova Zelanda | Diversos bacteris, BL |
| Kina | eriçons de mar | àlcali | Nova Zelanda | Diversos bacteris |
| Hákarl | carn de tauró | àlcali | Islàndia | Proteobacteris: Moraxella, Acinetobacter |
| Ngari | peix ciprínid | àcid | Índia, Himàlaia | BL, Bacillus, llevats |
| Surströmming | areng | àcid | Suècia, Europa N | Halanaerobium (arqueu), BL, altres bacteris |
| Nam-pla, bagoong i altres | peixos diversos | àcid, condiment | Àsia SE, Filipines, Europa | Bacillus, altres bacteris, arqueus halòfils |
| Garum | vísceres de peix | àcid, condiment | antigues Grècia, Roma, Bizanci | Diversos bacteris i arqueus |
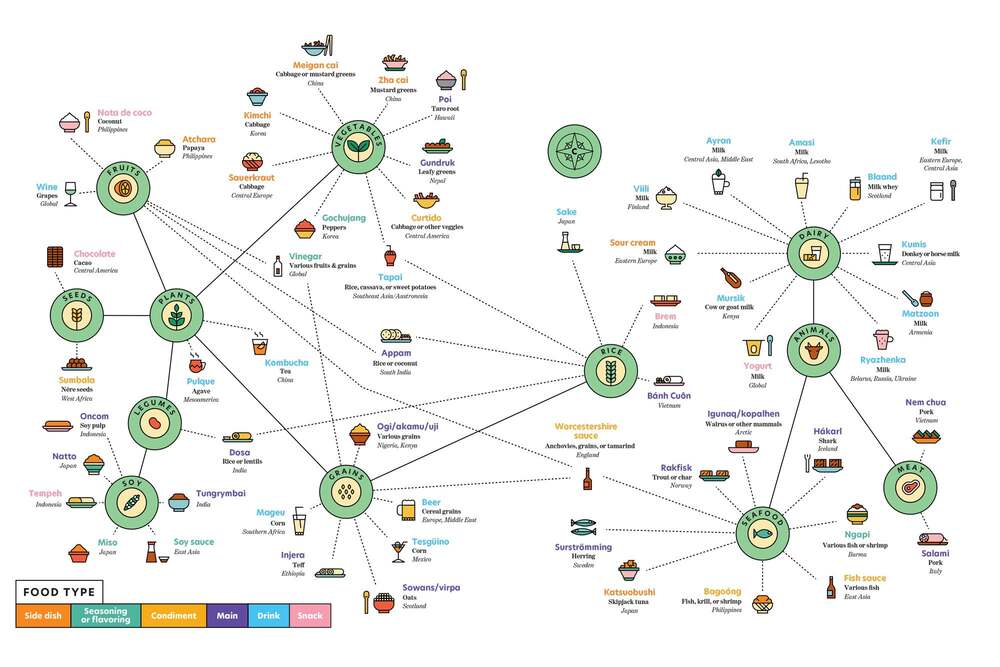
Els aliments fermentats són actualment una part important en la dieta humana a tot arreu, tant en regions on la seguretat alimentària i conservació actualment no estan ben controlades com en les més desenvolupades. És una tecnologia global entre els humans, i per tant és una prova de què prové dels primers humans. Com veiem (Taula 3), els substrats dels aliments poden ser vegetals, de les diferents parts de les plantes, o també de molt diversos animals.
A més, encara que les pràctiques culturals de fermentar aliments són molt variades globalment, sembla clar que en general els aliments fermentats ens agraden als humans. Aquesta preferència hauria emergit en paral·lel a una atracció adaptativa pels aromes i textures pròpies dels aliments fermentats per part dels primers humans. Per això podem observar com hi ha molts d’aquests aliments que són condiments, o sigui que s’afegeixen a altres aliments per tal de millorar la seva palatabilitat (Bryant et al 2023).
Aquesta gran diversitat dels aliments fermentats fa que alguns gustos i aromes ben estranys siguin molt apreciats per unes cultures i detestats per altres, com passa amb alguns formatges molt pudents, amb compostos volàtils amoniacals i de sofre. Hi ha una especificitat cultural en el seu consum. Els mateixos aromes que poden ser senyal de menjar “bo” en una cultura poden ser senyal de menjar dolent o passat en una altra. La capacitat per “degustar” menjars àcids, agres o amargs, gustos no habituals als aliments naturals i absents en altres animals, segurament ha evolucionat als humans amb la producció d’aliments fermentats (Frank et al 2022).
Com vèiem abans (Taules 1 i 2), el desenvolupament de la fermentació externa d’aliments va anar lligada a una pèrdua important de massa del còlon i de l’energia que s’hi produeix, i per tant això implica una reducció en la quantitat i diversitat de la microbiota intestinal perquè aquests no són tan necessaris. Això s’evidencia en fer anàlisis comparatives de la microbiota humana amb la dels altres homínids com ximpanzés, bonobos o goril·les (Moeller et al 2014).
D’altra banda, la preferència dels humans per als aliments fermentats també es demostra amb les anàlisis genètiques. Per exemple, alguns gens de receptors olfactius relacionats amb productes fermentats estan seleccionats positivament als humans i no als ximpanzés, com són els del metil-octanoat, d’olor afruitat produït pels llevats de vinificació, o del metilvalèric, aroma clau dels formatges madurats.
La capacitat de metabolitzar l’etanol produït a la fermentació alcohòlica i per tant poder consumir-lo en moderació és deguda a unes variants gèniques que codifiquen per a l’alcohol deshidrogenasa (ADH7), que lògicament s’haurien impulsat en els primers humans amb les primeres begudes obtingudes per fermentació. Tanmateix, sembla que aquesta capacitat seria prèvia als humans, ja que els altres grans primats la tenen, i fins i tot altres mamífers com alguns quiròpters. Tots ells són consumidors de fruites, que poden ser fermentades espontàniament a la natura, i per tant tots aquests animals haurien adquirit aquesta capacitat en consumir fruites que han estat parcialment fermentades (Janiak et al 2020). Així doncs els homínids ja estarien adaptats a metabolitzar l’etanol molt abans que els primers humans ho fessin de forma més dirigida (Carrigan et al 2015).
CONCLUSIÓ
Crec que aquesta hipòtesi de la fermentació externa dels aliments com a element clau en l’expansió del cervell observada en l’evolució des dels australopitecs als humans és molt versemblant. La fermentació dels aliments en molts casos és quasi espontània, inicialment requereix molt poca tecnologia i coneixements, i amb una mínima selecció dels productes resultants després de la fermentació, s’obtenen aliments més digeribles, i que es conserven millor, i que tenen gustos o textures nous i interessants.
Aquest desenvolupament dels aliments fermentats va permetre que no calgués tenir un volum considerable de còlon amb la seva microbiota tan diversa, per adquirir nutrients que es poden consumir elaborant-los prèviament. En reduir-se les necessitats calòriques del còlon, l’energia “sobrant” va poder ser dedicada cada cop més al cervell, facilitant-ne la seva expansió. Lògicament i en paral·lel, o en alguns casos posteriorment, els altres factors comentats com el consum de carn, noves tecnologies de cacera, socialització, i el foc, van permetre encara més aquest engrandiment del cervell, fins arribar als Homo sapiens.
Finalment, només vull comentar que aquest treball m‘ha agradat especialment perquè tot plegat lliga tres dels temes que més m’atrauen científicament:
1) Aliments fermentats, o tal com a l’article de Bryant et al es diu, “fermentació externa”. De fet aquest denominació d’externa m’ha sorprès, ja que no havia pensat mai en anomenar “fermentació interna” al conjunt de processos de modificació o degradació o síntesi de compostos que du a terme la microbiota intestinal. Però vaja, és veritat. En qualsevol cas, els aliments fermentats i els aspectes dels beneficis dels microorganismes (“els microbis bons”) han estat sempre el meu tema primordial de treball de recerca, i de docència, i d’interès des que vaig acabar la llicenciatura de Biologia, ara fa 50 anys.
2) Microbiota intestinal. Des de fa uns quants anys és un tema que m’interessa molt. Encara que no l’he treballat directament a nivell de recerca, sí que he anat coneixent-lo, i el toco una mica a nivell docent. Com estem veient aquests darrers anys el paper de la microbiota intestinal en el manteniment saludable del cos és molt més important del que ens pensàvem, si bé encara falta molt per conèixer. Curiosament i una mica decebut, he descobert amb aquest treball, que els humans hem prescindit una mica de la microbiota intestinal i l’hem reduït en comparació als altres primats, justament amb el desenvolupament d’aquesta “fermentació externa”.
3) Origen i evolució humana. Per descomptat, aquest tema m’interessa molt, com suposo que a tothom. Amb un cert coneixement dels sers vius i admirant com funciona tota l’evolució biològica, saber més de com va aparèixer la nostra espècie i les properes, és apassionant.
BIBLIOGRAFIA
Alexander C, Swanson KS, Fahey GC, Garleb KA (2019) Perspective: physiologic importance of short-chain fatty acids from nondigestible carbohydrate fermentation. Adv Nutr 10, 576–589
Amato KR, Chaves OM, Mallott EK et al (2021) Fermented food consumption in wild nonhuman primates and its ecological drivers. Am J Phys Anthropol 175, 513–530
Bryant KL, Hansen C, Hecht EE (2023) Fermentation technology as a driver of human brain expansion. Commun Biol 6, 1190
Bunn HT, Ezzo J (1993) Hunting and Scavenging by Plio-Pleistocene Hominids: Nutritional Constraints, Archaeological Patterns, and Behavioural Implications. J Archaeol Sci 20, 365-398
Carrigan MA, Uryasev O, Frye CB et al (2015) Hominids adapted to metabolize ethanol long before human-directed fermentation. Proc Natl Acad Sci USA 112, 458–463
Cordain L, Eaton S, Miller J et al. (2002) The paradoxical nature of hunter-gatherer diets: meat-based, yet non-atherogenic. Eur J Clin Nutr 56, S42–S52
Dyer R (2023) Food preserving technique may have sparked human brain growth, scientists say. Science Alert – Humans, 3/12/2023
Frank HER, Amato K, Trautwein M et al. (2022) The evolution of sour taste. Proc. Biol. Sci. 289, 20211918
Goren-Inbar N, Alperson N, Kislev ME et al. (2004) Evidence of Hominin Control of Fire at Gesher Benot Ya`aqov, Israel. Science 304,725-727
Hlubik S, Cutts R, Braun DR et al (2019) Hominin fire use in the Okote member at Koobi Fora, Kenya: New evidence for the old debate. J Human Evol 133, 214-229
Janiak MC, Pinto SL, Duytschaever G et al (2020) Genetic evidence of widespread variation in ethanol metabolism among mammals: revisiting the ‘myth’ of natural intoxication. Biol. Lett. 16, 20200070
Mann N (2000) Dietary lean red meat and human evolution. Eur J Nutr 39, 71–79 (2000)
Marean C, Bar-Matthews M, Bernatchez J. et al (2007) Early human use of marine resources and pigment in South Africa during the Middle Pleistocene. Nature 449, 905–908
McClave SA, Snider HL (2001) Dissecting the energy needs of the body. Curr Opin Clin Nutr Metab Care 4(2):143-7
Miller IF, Barton RF, Nunn CL (2019) Quantitative uniqueness of human brain evolution revealed through phylogenetic comparative analysis. eLife 8:e41250
Moeller AH, Li Y, Ngole EM et al (2014) Rapid changes in the gut microbiome during human evolution. Proc Natl Acad Sci USA 111, 16431–16435
O’Hara AM, Shanahan F (2006) The gut flora as a forgotten organ. EMBO Rep 7, 688–693
Padmaja G, Steinkraus KH (1995) Cyanide detoxification in cassava for food and feed uses. Crit Rev Food Sci Nutr 35, 299–339
Ponce de León MS, Bienvenu T, Marom A et al. (2021) The primitive brain of early Homo. Science 372, 165-171
Ohland CL, Macnaughton WK (2010) Probiotic bacteria and intestinal epithelial barrier function. Am J Physiol Gastrointest Liver Physiol 298, G807–19
Sandhu KS, Punia S, Kaur M (2017) Fermentation of cereals: a tool to enhance bioactive compounds. Plant biotechnology: Recent advancements and developments 157, 157–170
Speth JD (2019) Neanderthals, vitamin C, and scurvy. Quat. Int. 500, 172–184
Wrangham RW, Jones JH, Laden G et al. (1999) The Raw and the Stolen: Cooking and the Ecology of Human Origins. Curr Anthrop 40:5, 567-594
Microbis domesticats per fer vi
24 agost 2022
A banda d’animals i plantes, els humans també hem anat “domesticant” alguns microbis al llarg de la història, en anar desenvolupant els aliments fermentats. Els grups principals d’aquests microorganismes són els bacteris làctics de molts productes lactis i vegetals fermentats, els llevats de les begudes alcohòliques, i les floridures d’alguns formatges i derivats de la soja. En aquest article, després d’una breu introducció, em limito sobretot als microbis del vi, o sigui, als llevats de la fermentació alcohòlica com Saccharomyces cerevisiae i als bacteris de la fermentació malolàctica com Oenococcus oeni.
DOMESTICACIÓ
Quan el flux genètic entre poblacions de la mateixa espècie es redueix, usualment per aïllament, l’evolució pot donar lloc a subpoblacions diferents, que eventualment poden esdevenir espècies diferents. Els humans poden interferir en aquest procés natural limitant el flux genètic deliberadament, seleccionant determinats trets desitjats, o sigui, la selecció artificial. D’aquesta manera, algunes espècies acaben essent dependents d’ambients antropogènics i adquireixen trets evolutius que interessen als humans. Això és la domesticació.
Els trets buscats són molt diversos, des del rendiment (ex. ramaderia bovina o ovina o l’agricultura intensiva), passant per la tolerància al estrès (ex. collites resistents a sequera), fins arribar a l’estètica (ex. flors) o a la companyia (ex. gossos). Amb l’excepció dels gossos ja domesticats fa uns 30.000 anys, la majoria d’espècies domesticades ho foren durant la revolució neolítica fa uns 12.000 anys, amb el canvi de nomadisme de caçar i recol·lectar al sedentarisme lligat als conreus i al bestiar. En seleccionar els descendents d’animals i plantes que millor cobrien les necessitats específiques, aquests humans prehistòrics efectivament van començar a controlar els processos de selecció i el flux genètic (Steensels et al. 2019).
DOMESTICACIÓ DE MICROORGANISMES
Comparat amb la de plantes i animals, la domesticació de microbis ha estat ignorada molt de temps. Recentment, el gran augment de dades genòmiques disponibles ha permès conèixer amb precisió les relacions genètiques entre diferents microorganismes, amb la qual cosa s’ha vist que els microbis industrials sovint representen branques genètiques diferenciades i aïllades als arbres filogenètics. Tanmateix, les circumstàncies ambientals que la domesticació microbiana requereix i les característiques genètiques concretes no s’han estudiat amb detall.
Curiosament, mentre que la domesticació d’animals i plantes són sobretot el resultat de l’esforç humà a posta, la domesticació dels microbis ha succeït sobretot sense intenció. Cal recordar que l’existència dels microorganismes començà a finals del s. 17 amb Antoni van Leeuwenhoek, el seu paper a les fermentacions no fou desvelat fins al s. 19 amb Louis Pasteur i altres, i sobretot els primers cultius purs, en concret de llevats cervesers, no foren obtinguts fins a finals del s. 19 per Emil C. Hansen a la Carlsberg.
Però és clar, les fermentacions són conegudes des del neolític o abans, encara que no se sabés res dels microbis com a tal. Un dels primers passos per controlar una mica el procés de fermentació fou probablement la retro-inoculació (backslopping en anglès), on s’utilitza material —i per tant microbis— d’una fermentació prèvia per començar-ne una de nova. Amb això, aquells antics artesans van promoure sense pretendre-ho l’adaptació dels microbis a l’ambient fermentatiu antropogènic, i per tant fou una selecció “inconscient”.
Al llarg del procés de domesticació dels microbis, hi ha una competència contínua entre diferents variants, ja siguin espècies, soques o mutants, a cada ronda de fermentació. O sigui, també hi ha una supervivència dels més adaptats, com a la selecció natural, encara que aquí és en un ambient controlat pels humans. En canvi, això ha canviat aquests darrers decennis des que s’utilitza la inoculació de cultius purs, seleccionats prèviament en base a les característiques volgudes. Aquesta selecció més “artificial” s’assembla més a la domesticació tradicional d’animals i plantes. La introducció de les noves eines biotecnològiques aquests darrers anys ha permès dissenyar encara millor el microorganisme amb les propietats desitjades per a la fermentació, incloent-ne algunes, com la producció d’aromes exòtics, que no necessàriament donen un avantatge adaptatiu del microbi.
Recomano la revisió de Steensels et al. (2019) per repassar les característiques del procés de domesticació als principals grups de microbis industrials, que són els bacteris làctics, els llevats i les floridures. Com he esmentat al principi, aquí em centraré sobretot en els relacionats amb el procés de vinificació, o sigui llevats i bacteris làctics, i per aquest ordre, de rellevància i temporalitat al vi.
DOMESTICACIÓ DELS LLEVATS
Els llevats són fongs unicel·lulars, i per tant microscòpics. Tenen uns 4 micròmetres de diàmetre, encara que alguns poden arribar fins a 40 µm, i ocasionalment alguns fan prolongacions o cadenes de cèl·lules conegudes com pseudohifes. Es reprodueixen sobretot asexualment per mitosi amb gemmació, una divisió asimètrica on el llevat fill més petit és la gemma. En condicions d’estrès poden esporular i després de la meiosi es produeixen espores haploides, que poden conjugar. La majoria són ascomicets però també n’hi ha de basidiomicets, i encara que hi ha unes 1500 espècies de llevats, el “llevat” per antonomàsia és Saccharomyces cerevisiae.
Encara que no exclusius del vi, els llevats S. cerevisiae són el model perfecte de domesticació microbiana perquè, malgrat ser eucariotes, tenen un genoma petit (12 Mb i 6500 gens, enfront la mitjana als ascomicets que és de 36 Mb i 11000 gens) i ben estudiat, temps de generació curts i es disposa de moltes eines per fer-hi recerca genètica i fenotípica.
S. cerevisiae només és abundant a les fermentacions de fruita recollida artificialment, com als raïms veremats un cop són al celler. En canvi, de forma natural s’ha trobat a molts hàbitats però en nombres escassos, i en particular a les fruites, al raïm mateix, i a l’escorça dels roure, que semblen ser els seus nínxols ecològics, però en qualsevol cas en nombres escassos (Steensels et al. 2019).
Per això s’ha proposat que S. cerevisiae no és que estigui adaptat a cap nínxol específic sinó que es pot dir que és una espècie nòmada, capaç de sobreviure com a generalista poc abundant en un ample ventall d’ambients. Pot sobreviure en molt diverses condicions i encara que el seu genoma és petit, és força complex i de fet per créixer als medis de laboratori només li calen el 20% dels seus 6500 gens (Goddard & Greig 2015).
Però malgrat no tenir clar quin és el seu hàbitat natural, està clar que el seu segon hàbitat són molts ambients artificials de fermentacions com les de pa, cervesa i vi. S. cerevisiae és conegut per les seves excel·lents característiques fermentatives, fins i tot en presència d’oxigen. Aquest caràcter sorgí com un procés evolutiu, adquirint la capacitat de créixer en medis amb molts sucres però amb pocs dels altres nutrients, i de convertir aquests diversos sucres a etanol, un compost antimicrobià per al qual aquest llevat és molt tolerant. El vi es considera la primera beguda fermentada alcohòlica, de fa uns 9000 anys (Fay et al. 2019). Amb tot, S. cerevisiae no és la única espècie per produir begudes alcohòliques, vins inclosos, ja que també ho són altres Saccharomyces relacionats: S. uvarum, S. eubayanus, S. kudriavzevii i altres derivats híbrids (González et al. 2006)
Com que l’etanol és un bon preservatiu natural enfront de microbis no desitjats, i addicionalment té la capacitat de ser una substància addictiva, la fermentació d’aliments per llevats va esdevenir una pràctica ben estesa, i va sorgir independentment en diverses civilitzacions arreu del món.
Per estudiar el probable origen de S. cerevisiae i la relació entre les seves diverses soques, en un estudi recent de seqüenciació i anàlisi dels SNPs (polimorfismes d’un sol nucleòtid) de més de 600 soques d’aquesta espècie (Duan et al. 2018) s’ha vist que les soques silvestres, de diversos continents però sobretot de la Xina, se separen quasi totes de les domesticades, excepte les aïllades en roures i altres Quercus, que són més properes als de les soques pròpies de vins i de cerveses (Figura 1). Com veiem, les soques domesticades es distribueixen en 2 branques evolutives. Una branca agrupa soques de fermentacions en estat sòlid, sobretot d’Àsia i en particular de la Xina. I l’altra inclou les pròpies de fermentacions líquides com els vins i les cerveses i altres, a més de les esmentades dels Quercus. Tot plegat, els autors (Duan et al. 2018) postulen un hipotètic origen de l’espècie, i sobretot de la seva domesticació, a la Xina o l’est asiàtic en general.
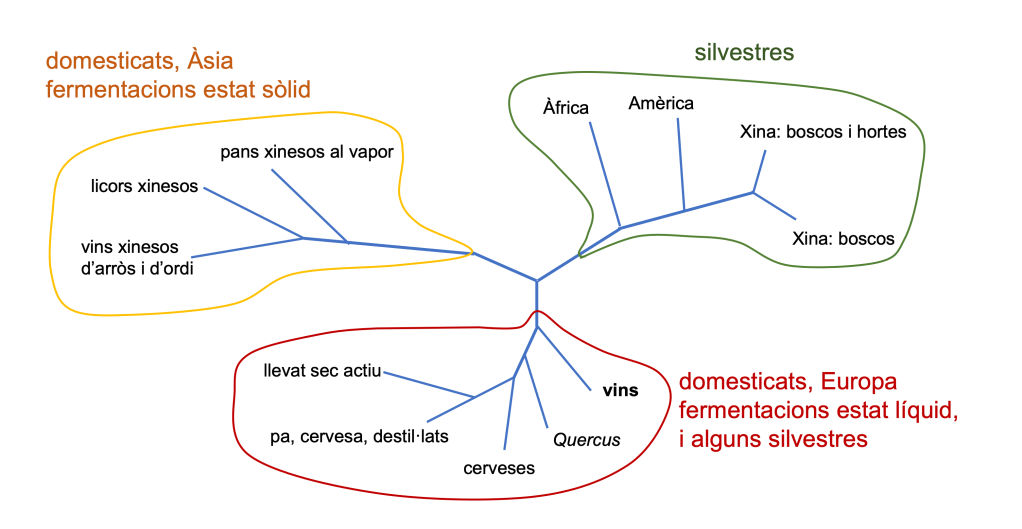
Aquesta proximitat evolutiva de les soques de S. cerevisiae del vi amb les dels Quercus podria ser perquè aquests arbres fossin l’origen silvestre de les víniques o també perquè hi hagués hagut un retorn a la natura d’alguna soca vínica (Steensels et al. 2019).
Les soques de llevats domesticades dels diversos processos en estat líquid, o industrials “europees”, a més de ser diferents de les silvestres, s’agrupen filogenèticament força amb l’aplicació industrial, ja sigui cervesa o vi (Figura 2). Les soques domesticades de S. cerevisiae tenen reforçats uns trets que les fan idònies per a l’ambient fermentatiu, com l’adaptació a concentració alta de sucres, ambients amb poc O2 i tolerància a l’etanol, però també alguns trets específics del producte. Per exemple, els llevats cervesers poden metabolitzar maltotriosa, sucre específic del malt, mentre que els llevats vínics tenen una bona resistència als agents antimicrobians emprats, el sulfat de coure a la vinya i el sulfurós al celler. Com veiem (Figura 2), els S. cerevisiae del vi tenen una domesticació més limitada que els cervesers. Per exemple, els cervesers han perdut la capacitat de supervivència fora de l’entorn fermentatiu, mentre que els vínics poden esporular i sobreviuen a l’entorn extern. Això segurament és degut a que la fermentació del vi només passa un cop cada any, després de la verema, i la resta de l’any els llevats han de sobreviure al celler o a l’entorn en un ambient més natural (Steensels et al. 2019).
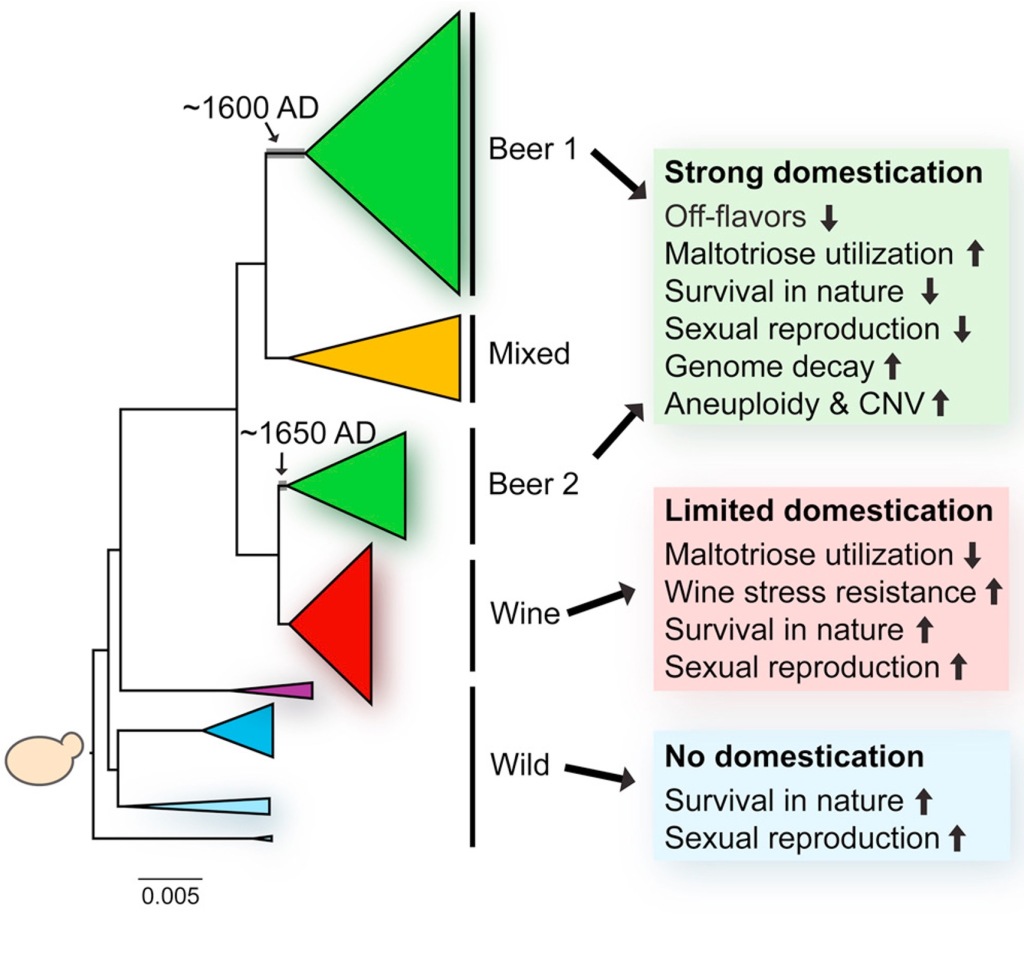
Cal afegir a aquestes diferències entre els llevats vínics i els cervesers, la molt més gran diversitat gènica dels llevats cervesers. De fet, molts d’aquests són S. cerevisiae, que inclouen els anomenats d’alta fermentació com els de les cerveses ale i stout i moltes més de tot el món, però justament les cerveses de baixa fermentació lager, que són el 94% del mercat mundial, són dutes a terme per S. pastorianus (sinònim S. carlsbergensis), per tant una altra espècie. Aquest S. pastorianus és un híbrid al·lotetraploïde de S. cerevisiae amb el llevat criotolerant S. eubayanus, i s’originà domèsticament cap al segle 15 a Baviera sotmetent les cerveses a baixes temperatures de coves dels Alps. Per això aquest llevat actua a 7-13ºC, i al fons del fermentador (Libkind et al. 2011).
Totes les altres cerveses d’alta fermentació són elaborades amb molt diverses S. cerevisiae, constituint un grup polifilètic, amb moltes branques evolutives, algunes de les quals són filogenèticament properes a les del sake, del vi i del pa. La diversitat de nucleòtids dels S. cerevisiae cervesers és més del doble que la dels vínics. Aquesta major diversitat segurament és deguda a la suara comentada utilització estacional dels llevats vínics a diferència dels cervesers tot l’any, i també als més intensos i diferents règims de selecció associats a la seva elaboració (Gonçalves et al. 2016).
Amb tot això, tenim l’aparent paradoxa que les cerveses, com que la majoria de les consumides són lager, i moltes d’elles produïdes a gran escala industrial, semblen ser més estandarditzades comercialment i per tant més uniformes, i en canvi els vins semblen ser més diversos, en contra del que acabem de veure de la molt major diversitat de soques de llevats cerveseres que víniques.
CANVIS GENÈTICS CAP A LA DOMESTICACIÓ DE SACCHAROMYCES CEREVISIAE DEL VI
En centrar-nos en el vi, cal recordar que en començar la fermentació espontània del most de raïm les soques de S. cerevisiae no són predominants i hi ha un ampli espectre d’altres llevats, coneguts com no-Saccharomyces: Hanseniaspora, Pichia, Lachancea, Metschnikowia o Torulaspora i altres gèneres (Fleet et al. 1984). Per efecte de la producció d’etanol, S. cerevisiae acaba predominant i desplaçant en nombre a las no-Saccharomyces. Encara que cada cop més s’estan veient els beneficis d’aquests altres llevats a nivell d’aromes i s’estan utilitzant com a estàrters addicionals a S. cerevisiae (Jolly et al. 2014), no es pot parlar de la domesticació d’aquests no-Saccharomyces perquè no tenen fins ara un paper primordial en la vinificació, no es pot elaborar cap vi només amb aquests altres llevats. Per tant aquí em limitaré a S. cerevisiae.
Molts dels mecanismes de canvis genètics que han portat a la domesticació de S. cerevisiae a la vinificació són presents també en altres espècies domesticades, tant microbianes com animals i plantes. El mecanisme més fàcil d’establir com a canvi genètic són els SNPs, degudes a mutacions puntuals d’un sol nucleòtid, però s’ha vist que aquests SNPs representen tan sols una petita fracció dels relacionats amb la domesticació de S. cerevisiae, i en canvi la majoria són rearranjaments estructurals del genoma, com els següents.
Les variacions en el nombre de còpies (CNV en anglès) són mutacions molt freqüents a molt diversos organismes, on fragments de DNA de > 1kb són repetits, tenen diverses còpies, amb nombre variable. El cas més conegut en els llevats vínics és el gen CUP1, que codifica per a una metal·lotioneïna, proteïna captadora de coure. Algunes soques poden tenir fins a 18 còpies d’aquest gen, amb la qual aquests S. cerevisiae vínics produeixen més quantitat de la proteïna i per tant són més tolerants al coure de la “barreja de Bordeus” usada com a fungicida a les vinyes (Steensels et al 2019).
Els rearranjaments cromosòmics, amb delecions, insercions o translocacions de grans fragments de cromosomes, sovint causades per transposons, són relativament freqüents en l’evolució dels llevats vínics i de Saccharomyces en general. De fet, aquests rearranjaments que poden afectar un nombre important de gens són una causa important de especiació. Un exemple n’és la tolerància al sulfit —l’antibacterià més usat en vinificació— degut a l’al·lel SSU1-R que és el producte sobreexpressat d’una translocació entre els cromosomes 8 i 16, només present als llevats vínics (Pérez-Ortín et al. 2002).
La hibridació interespecífica és un altre mecanisme de canvis que ja hem vist com a origen dels llevats domesticats a les cerveses lager. Les espècies de Saccharomyces poden hibridar molt fàcilment entre elles ja que aquests híbrids poden propagar-se per mitosi tan eficientment com els seus progenitors, encara que rarament poden fer la meiosi i per tant, quasi mai produeixen espores viables (Sipiczki 2008). Malgrat això, alguns dels llinatges híbrids poden acabar ser reconeguts com a espècies. Els casos més coneguts són l’esmentat S. pastorianus (sinònim S. carlsbergenesis) (S. cerevisiae x S. eubayanus) de les lager, i els S. bayanus (S. cerevisiae x S. eubayanus x S. uvarum) del vi (Figura 3). Tanmateix, S. bayanus és controvertit per les seves similituds amb S. cerevisiae i genera confusió de noms d’espècies amb alguna de les soques comercials més utilitzades (Sipiczki 2008).
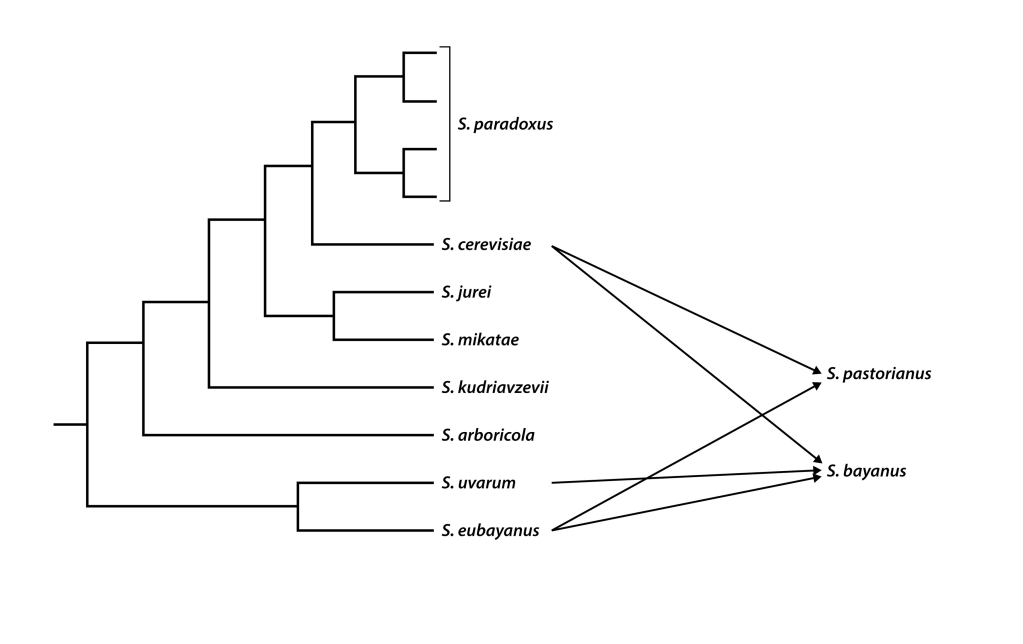
Els híbrids també han estat clau en l’aparició de força llevats vínics, sobretot en relació a la possibilitat de fermentar a baixes temperatures. Per exemple, algunes de les soques comercials d’estàrters que fermenten vi a 15ºC són híbrids “naturals” de S. cerevisiae amb S. kudriavzevii amb poliploïdia parcial, aïllats el 1979, que tenen la bona producció d’etanol de S. cerevisiae i la tolerància al fred de S. kudriavzevii (Erny et al. 2012).
De fet, recentment la hibridació interespecífica de diversos Saccharomyces vínics —per exemple S. cerevisiae x S. uvarum— s’està realitzant als laboratoris per tal d’aconseguir soques amb millors característiques relacionades amb caràcters poligènics. La hibridació com a mètode té l’avantatge de no ser considerada una tècnica GMO (organisme modificat genèticament, en anglès) i per tant les soques poden ser transferides ràpidament a la indústria (García-Ríos et al. 2019).
La transferència genètica horitzontal (TGH) és un altre mecanisme molt important evolutivament en molts organismes i en els llevats vínics també se’n coneixen alguns casos que han contribuït a la seva domesticació. Un cas és el gen Fsy1 codificant del transportador de fructosa, que permet a S. cerevisiae la utilització de la fructosa al final de fermentació, després d’haver consumit la glucosa. És molt probable que aquest gen li fou transferit del similar de S. pastorianus, per al que presenta molta homologia (Galeote et al. 2010). Un altre cas demostrat de TGH és el del gen Fot originari d’un altre llevat, Torulaspora microellipsoides, que li permet a S. cerevisiae una millor incorporació d’oligopèptids, que li donen avantatge competitiu quan les fonts de nitrogen són escasses (Marsit et al. 2015).
LLEVATS del VI DOMESTICATS o TORNEM ALS SILVESTRES ?
Malgrat els avantatges en la fermentació del vi que ha suposat l’ús d’aquests llevats evolucionats, això ha comportat una certa uniformització en les característiques del vi, sobretot a nivell d’aromes, perquè la majoria dels llevats utilitzats pertanyen a un sol llinatge genètic de S. cerevisiae domesticat. Com a contramoviment a això i també pel desig general de productes més “naturals” o ecològics, darrerament hi ha una tendència a utilitzar microorganismes silvestres i/o autòctons enlloc de les soques “domesticades”, o deixar més les fermentacions espontànies. Això passa amb el vi però també amb la cervesa i altres begudes i aliments fermentats (Steensels et al. 2014). En el vi, la tendència principal és sobretot l’ús de llevats no-Saccharomyces, presents de forma natural a l’inici de la fermentació, com he comentat abans, que donen perfils aromàtics diferents i molt interessants (Padilla et al. 2016). I encara més, els avenços en la comprensió de la domesticació combinats amb les noves tècniques disponibles per a l’evolució dirigida de microorganismes possibilitaran la creació de nous llinatges domesticats (Steensels et al. 2019).
———————–
DOMESTICACIÓ DELS BACTERIS LÀCTICS
El vi, juntament amb la cervesa i el pa, són els productes principals lligats a la domesticació comentada del llevat, S. cerevisiae bàsicament, amb algun altre molt relacionat com hem vist. Per tant, tenim unes poques espècies d’un sol gènere amb una gamma limitada de productes. En canvi, els bacteris làctics (BL) comprenen moltes espècies i ben diverses, que intervenen a molt diversos productes, tant derivats de la llet com de vegetals i d’altres aliments (Taula 1), molts més que els 3 bàsics dels llevats. Paradoxalment i tanmateix, al vi pràcticament només tenim una sola espècie de bacteri làctic domesticat, Oenococcus oeni, com tot seguit comentaré.
Els BL són bacteris gram-positius, de baix G+C al seu DNA, no esporulats, de metabolisme fermentatiu sense respiració, que produeixen àcid làctic com a producte principal de la fermentació de carbohidrats. Del punt de vista taxonòmic són l’ordre Lactobacillales, de la classe Bacilli, dins el fílum Firmicutes. Els seus hàbitats naturals són moltes plantes, especialment els fruits rics en sucres, i els animals, especialment els mamífers i entorn les seves llets, però també a l’interior dels seus cossos, com a la microbiota de boca i digestiu.
Els BL són el grup de microorganismes més important en la producció d’aliments i begudes fermentats, als que contribueixen en aroma, textura, seguretat i qualitat. La seva domesticació fou clau en la conservació d’aliments, i va resultar en molts cultius iniciadors per a la producció d’aliments industrials fermentats.
A nivell industrial, els productes làctics més coneguts són els lactis o derivats de la llet (Taula 1), on els BL predominants són Lactococcus i diversos gèneres actuals derivats de Lactobacillus (Zheng et al. 2020). En aquests dos grups, la domesticació va anar associada a pèrdua de gens de rutes biosintètiques —d’aminoàcids per exemple— i d’estrès oxidatiu, així com adquisició per TGH de gens per a un creixement òptim en l’ambient lacti, com els d’utilització de caseïna i de lactosa (Bonham et al. 2017).
Taula 1. Aliments (i begudes) fermentats amb intervenció de bacteris làctics (BL). Els BL o bacteris de l’àcid làctic (BAL, en anglès LAB) són de l’ordre Lactobacillales del fílum Firmicutes. Taula modificada i adaptada de Leroy & de Vuyst (2004). S’ha exclòs Bifidobacterium, que hi era a l’original, perquè no es dels Lactobacillales sinó del fílum Actinobacteria. S’han actualitzat els nous noms del gènere Lactobacillus (Zheng et al 2020).
| Tipus de producte | Producte fermentat | BL predominants a, b |
| Productes lactis | Formatges | Lc. lactis, Le. mesenteroides, Lb. delbrueckii, Lb. helveticus, Lcb. casei, St. thermophilus |
| Mantega i similars | Lc. lactis, Le. mesenteroides | |
| Iogurt | Lb. delbrueckii, St. thermophilus | |
| Altres llets fermentades c | Lcb. casei, Lb. acidophilus, Lcb. rhamnosus, Lb. johnsonii | |
| Quefir | Lnb. kefiri, Lb. kefiranofaciens, Lvb. brevis | |
| Carns fermentades | Embotits europeus | Ltb. sakei, Ltb. curvatus |
| Embotits USA | P. acidilactici, P. pentosaceus | |
| Peix fermentat | Plaa-som, bagoóng, garum i altres | Clb. alimentarius, C. piscicola |
| Vegetals fermentats | Xucrut | Le. mesenteroides, Lpb. plantarum, P. acidilactici |
| Olives | Lpb. pentosus, Lpb. plantarum, Le. mesenteroides | |
| Envinagrats: cogombrets, albergínies i altres | Le. mesenteroides, P. cerevisiae, Lvb. brevis, Lpb. plantarum | |
| Kimchi | Le. mesenteroides, Le. kimchii, Ltb. sakei, Lpb. plantarum, W. kimchii, P. pentosaceus | |
| Salsa de soja | T. halophilus | |
| Cereals fermentats | Massa mare | Flb. sanfranciscensis, Lvb. brevis, Lpb. plantarum |
| Begudes alcohòliques | Fermentació malolàctica del vi | O. oeni |
| Vi d’arròs | Ltb. sakei | |
| Cerveses làmbic o similars | Pediococcus spp. |
b A banda de possibles altres microorganismes no BL
c Incloent les de probiòtics afegits
——————–
BACTERIS LÀCTICS DEL VI, OENOCOCCUS OENI I LA SEVA DOMESTICACIÓ
De la mateixa manera que amb els llevats, com que les fermentacions víniques no són estèrils, al most poden haver-hi molt diversos bacteris, incloent els BL. D’aquests, els més habituals durant la fermentació alcohòlica, si bé en nombres baixos —inferiors a 104 UFC/mL—, són Oenococcus oeni, Lactiplantibacillus plantarum, Lentilactobacillus hilgardii, Levilactobacillus brevis, Fructilactobacillus lindneri, Pediococcus parvulus i algun altre (Capozzi et al. 2021).
Però al final de la FA, quan el contingut d’etanol produït pels llevats ja és superior a 10% (v/v), aleshores la gran majoria de bacteris inclosos quasi tots els BL són inhibits, i pràcticament només hi romanen —i hi poden créixer lleugerament— les soques de O. oeni (Franquès et al. 2017), que duen a terme la fermentació malolàctica (FML) o conversió de L-màlic a L-làctic. Aquesta FML té els beneficis de reducció de l’acidesa, millora organolèptica i estabilitat microbiològica del vi (Bartowsky 2008). A banda de O. oeni, ocasionalment en alguns vins la FML pot ser duta a terme per altres BL, sobretot per Lpb. plantarum (Krieger-Weber et al. 2020).
Per tant, Oenococcus oeni és el bacteri del vi per excel·lència, degut a la seva tolerància a l’etanol i la capacitat de sobreviure en un medi àcid i amb polifenols i amb ben pocs nutrients com és el vi. La seva excepcionalitat està clar que va lligada a la seva domesticació —involuntària per als humans— i adaptació a aquest entorn artificial del vi durant aquests darrers milers d’anys.
CANVIS GENÈTICS CAP A LA DOMESTICACIÓ DE OENOCOCCUS OENI AL VI
Els bacteris gram-positius amb fermentació heterolàctica de sucres i forma de coc que realitzen la FML del vi foren classificats com Leuconostoc oenos per Garvie (1967) per la semblança amb altres Leuconostoc. Tanmateix, els del vi es distingeixen dels altres Le. pel creixement en medi àcid, la tolerància a l’etanol, i la pobre fermentació de carbohidrats, a més de les estructures diferenciades d’enzims clau com la D-lactat deshidrogenasa o la glucosa-6-fosfat deshidrogenasa. L’estudi filogenètic del gen 16S rRNA per Yang & Woese (1989) va revelar una línia ben diferenciada d’aquests bacteris del vi respecte a altres Leuconostoc i d’altres BL (Figura 4). Aquests autors ja observaren que la seqüència del 16S rRNA de “Le. oenos“, a més de ser molt distant de tots els altres Leuconostoc, tenia inusualment alterada la composició en posicions altament conservades. Per tot això Dicks et al. (1995) van proposar el nou nom de gènere i espècie Oenococcus oeni.
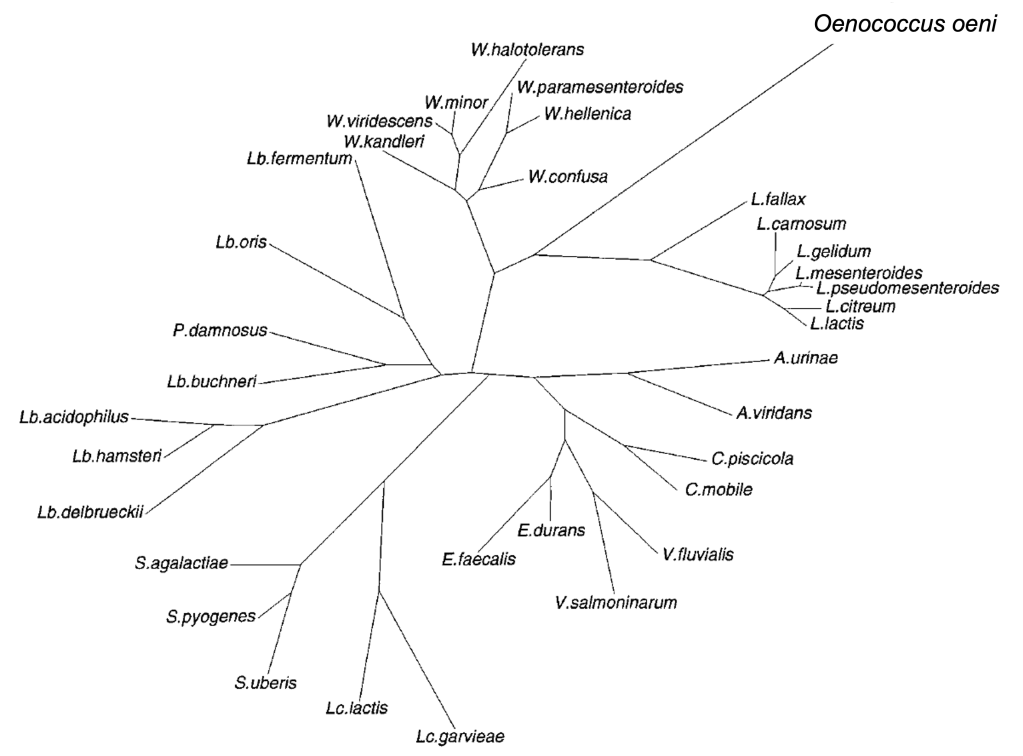
Aquesta branca filogenètica ben llarga i diferenciada de O. oeni és indicativa de la ràpida evolució que aquest bacteri ha experimentat en la domesticació i adaptació al vi. Les característiques genòmiques principals d’aquesta espècie respecte a altres BL són d’una reducció gènica a tots els nivells (Makarova et al. 2006), la qual cosa es correspon amb la molt menor capacitat biosintètica (aminoàcids, vitamines, etc.):
- El genoma de O. oeni és de 1.78 Mbp, el més petit dels BL, que van de 1.8 de diversos Streptococcus a 3.3 de Lpb. plantarum.
- El nombre d’operons rRNA de O. oeni és 2, el menor de tots els BL, ja que alguns com Lb. delbrueckiii en tenen 9.
- El nombre de tRNAs de O. oeni és 43, el menor de tots els BL, enfront de 55-98 dels altres, relacionat amb el menor creixement i la menor competitivitat ecològica.
A banda de la reducció gènica, a Oenococcus s’observen taxes més elevades de mutacions que a d’altres BL, és un gènere hipermutable (Taula 2). La causa és que hi són absents els gens mutS i mutL, que són gens de reparació d’errors d’aparellament (MMR, mismatch repair), mentre que aquests gens són presents a tots els altres BL. El tipus de mutacions més freqüent són les transicions (GC –> AT i AT –> GC). Això explica l’alt nivell de polimorfisme al·lèlic, que probablement va conduir a la seva adaptació als ambients àcids i amb etanol (Marcobal et al. 2008). L’alta mutabilitat devia generar algunes mutacions beneficioses per a ambients molt restrictius com és el vi, a diferència d’altres BL, com per ex. Leuconostoc o Pediococcus, que es troben en molt diversos hàbitats. A més, el gènere Oenococcus és un exemple de com la manca dels gens MMR pot portar a la especiació.
Taula 2. Hipermutabilitat de O. oeni respecte a altres BL (adaptat de Marcobal et al. 2008)
| Espècie | Taxes de mutació espontània amb rifampicina | Taxes de mutació espontània amb eritromicina | % Transicions (GC-AT i AT-GC) / total mutacions |
| Oenococcus oeni | 1.6 x 10-6 | 1.6 x 10-6 | 83 |
| Leuconostoc mesenteroides | 1.5 x 10-8 | 4.2 x 10-9 | 28 |
| Pediococcus pentosaceus | 5.5 x 10-8 | 4.7 x 10-9 | 33 |
Aquesta hipermutabilitat ha originat la gran diversitat de soques de O. oeni que trobem en totes les regions vinícoles mundials, i quan s’estudien els seus genomes per diversos mètodes moleculars com els SNP (polimorfismes d’únic nucleòtid), s’observen (Figura 5) agrupacions de soques relacionades amb el tipus de producte, com les de xampany o de la sidra —on també és present aquest bacteri—, resultat de la domesticació-adaptació als diversos ambients on realitza la FML. També es troba O. oeni com a BL predominant a la kombutxa, la beguda de té fermentat per una comunitat de llevats, acètics i soques específiques de O. oeni i altres BL (Lorentzen & Lucas 2019).
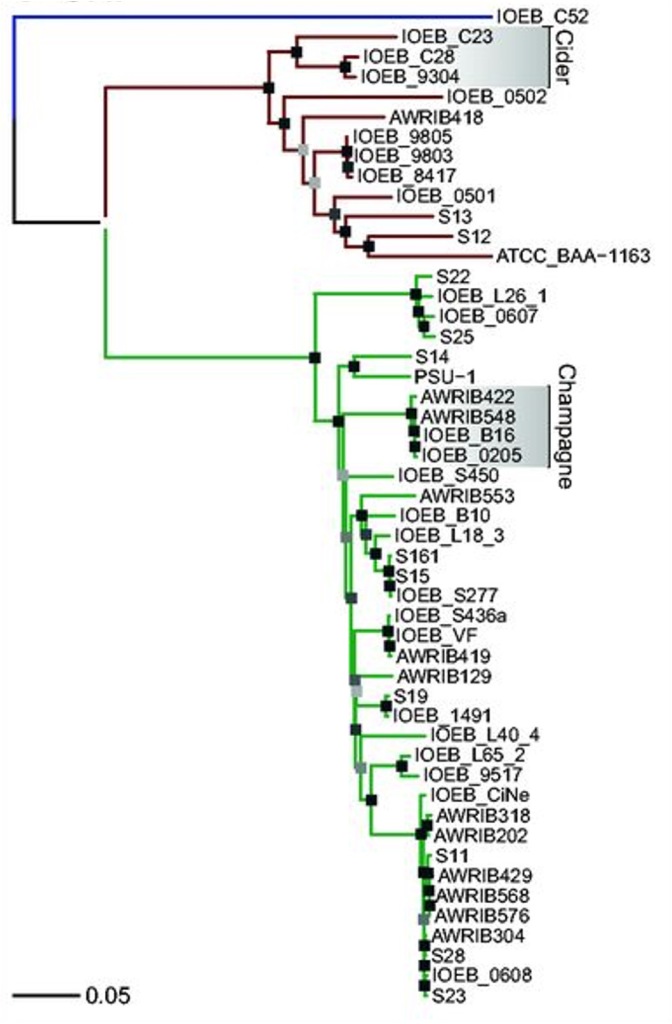
OENOCOCCUS OENI, EL BACTERI DOMESTICAT QUASI NOMÉS PRESENT AL VI
Aquesta és potser l’evidència més clara de què O. oeni és un bacteri producte de la domesticació. De manera semblant al cas dels llevats i en aquest cas es pot dir que encara amb més certesa, és molt difícil trobar O. oeni fora del vi en ambients naturals. Les poblacions de BL al most de raïm són com a molt 104/mL, i O. oeni només és una petita part d’aquests. Hi ha molts pocs estudis on se’ls hagi pogut aïllar dels raïms o del most. En destaca el treball recent de Franquès et al. (2017) on s’aconseguiren aïllar-ne diverses soques al Priorat. Algunes d’aquestes foren també aïllades als mateixos vins, i es confirmà la presència del DNA d’O. oeni als mateixos raïms.
Malgrat la minsa presència d’aquest bacteri als raïms i al most, un cop la fermentació alcohòlica està acabant i el vi conté una quantitat significativa d’etanol produït pels llevats, els pocs inicials O. oeni poden haver assolit unes poblacions suficients per realitzar la FML. A banda del most, també és molt probable que els bacteris ja hi siguin al celler, a les superfícies o interior dels equipaments, ja que s’han detectat soques comercials de O. oeni a cellers on se n’havia utilitzat anys abans (Lorentzen & Lucas 2019).
CONCLOENT, LA DOMESTICACIÓ INCONSCIENT DELS MICROBIS DEL VI HA GENERAT DOS MOLT EXCEPCIONALS
El llevat Saccharomyces cerevisiae és l’espècie principal implicada a la fermentació alcohòlica del vi, i el bacteri làctic Oenococcus oeni ho és per a la fermentació malolàctica. En canvi, abans de les fermentacions respectives quasi no hi són. Si no s’inoculen estàrters, els nombres de S. cerevisiae són molt baixos al most, i O. oeni pràcticament no apareix al vi fins al final de la fermentació alcohòlica. Per tant, es pot dir que si els humans no haguessin començat a fer vi —i cervesa en el cas dels llevats— fa alguns milers d’anys, aquestes dues espècies segurament no existirien. Són clarament microbis domesticats en el sentit que han aparegut evolutivament en un temps relativament breu com a derivats de microbis previs que no tenien les característiques específiques d’aquests dos.
Com hem vist, l’excepcionalitat de Saccharomyces (“el fong del sucre”), i en particular S. cerevisiae, és sobretot la capacitat de fermentar medis amb molts sucres, convertint-los a etanol en quantitats importants, per al qual aquest llevat és molt tolerant. Aquesta producció d’etanol és bioquímicament excepcional i única entre els fongs i els altres organismes. Vegeu al respecte el treball de Dashko et al. (2014) sobre l’evolució de la fermentació alcohòlica als llevats.
L’excepcionalitat d’O. oeni (“el coc del vi del vi”) també és ben evident. És una espècie “nascuda i modelada” al vi (Bech-Terkilsen et al. 2020), capaç de sobreviure en un medi ben hostil, amb etanol, pH baix i molt pocs nutrients. Hi subsisteix gràcies al L-màlic i algunes restes de les cèl·lules de llevats, com és el cas de les manoproteïnes (Balmaseda et al. 2021), i és resistent a l’estrès d’aquestes condicions extremes gràcies a algunes proteïnes protectores del xoc de l’etanol, als sistemes antioxidants com el glutatió (Margalef-Català et al. 2016), i també en part degut a l’acumulació de manganès —també antioxidant, i molt poc estudiat—, el qual a més és cofactor de l’enzim malolàctic (Makarova et al. 2006). Per tot això, O. oeni pot ser una espècie model d’estrès per als altres BL (Liu 2002).
BIBLIOGRAFIA
Balmaseda A, Aniballi L, Rozès N, Bordons A, Reguant C (2021) Use of yeast mannoproteins by Oenococcus oeni during malolactic fermentation under different oenological conditions. Foods 10, 1540
Bartowsky EJ (2008) Oenococcus oeni and malolactic fermentation —moving into the molecular arena. Aust J Grape Wine Res 11: 174-187
Bech-Terkilsen S, Westman J, Swiegers J, Siegumfeldt H (2020) Oenococcus oeni, a species born and moulded in wine: a critical review of the stress impacts of wine and the physiological responses. Aust J Grape Wine Res 26, 188-206
Bonham KS, Wolfe BE, Dutton, R.J. (2017) Extensive horizontal gene transfer in cheese-associated bacteria. Elife 6, e22144
Campbell-Sills H, El Khoury M, Favier M, Romano A, Biasioli F et al. (2015) Phylogenomic Analysis of Oenococcus oeni Reveals Specific Domestication of Strains to Cider and Wines. Genome Biol Evol 7, 1506–1518
Capozzi V, Tufariello M, De Simone N, Fragasso M, Grieco F (2021) Biodiversity of Oenological Lactic Acid Bacteria: Species- and Strain-Dependent Plus/Minus Effects on Wine Quality and Safety. Fermentation 7, 24
Dashko S, Zhou N, Compagno C, Piškur J (2014) Why, when, and how did yeast evolve alcoholic fermentation?. FEMS Yeast Res, 14, 826–832
Dicks LMT, Dellaglio F, Collins MD (1995) Proposal to reclassify Leuconostoc oenos as Oenococcus oeni [corrig.] gen. nov., comb. nov. Int. J. Syst. Bacteriol. 45, 395–397
Duan SF, Han PJ, Wang QM, Liu WQ, Shi JY et al (2018). The origin and adaptive evolution of domesticated populations of yeast from Far East Asia. Nat. Commun. 9, 2690
Erny C, Raoult P, Alais A, Butterlin G, Delobel P et al. (2012) Ecological Success of a Group of Saccharomyces cerevisiae/Saccharomyces kudriavzevii Hybrids in the Northern European Wine-Making Environment. Appl Environ Microbiol 78, 9
Fay JC, Liu P, Ong GT, Dunham MJ, Cromie GA et al. (2019) A polyploid admixed origin of beer yeasts derived from European and Asian wine populations. PLoS Biol 17(3): e3000147
Fleet GH, Lafon-Lafourcade S, Ribereau-Gayon P (1984). Evolution of yeasts and lactic acid bacteria during fermentation and storage of Bordeaux wines. Appl Environ Microbiol 48, 1034–1038
Franquès J, Araque I, Palahí E, Portillo MC, Reguant C, Bordons A (2017) Presence of Oenococcus oeni and other lactic acid bacteria in grapes and wines from Priorat (Catalonia, Spain). LWT Food Sci Technol 81, 326-334
Galeote V, Novo M, Salema-Oom M, Brion C, Valerio E et al. (2010) FSY1, a horizontally transferred gene in the Saccharomyces cerevisiae EC1118 wine yeast strain, encodes a high-affinity fructose/H+ symporter. Microbiology 156, 3754–3761
Gallone B, Steensels J, Prahl T, Soriaga L, Saels V et al (2016) Domestication and divergence of Saccharomyces cerevisiae beer yeasts. Cell 166, 1397–1410.e1316
García-Ríos E, Guillén A, de la Cerda R, Pérez-Través L, Querol A, Guillamón JM (2019) Improving the Cryotolerance of Wine Yeast by Interspecific Hybridization in the Genus Saccharomyces. Front Microbiol 9, 3232
Garvie EI (1967) Leuconostoc oenos sp. nov. J Gen Microbiol 48, 431–438
Goddard MR, Greig D (2015) Saccharomyces cerevisiae: a nomadic yeast with no niche ? FEMS Yeast Res. 15, 1–6
Gonçalves M, Pontes A, Almeida P, Barbosa R, Serra M et al (2016) Distinct Domestication Trajectories in Top-Fermenting Beer Yeasts and Wine Yeasts, Current Biology 26, 2750-2761
González SS, Barrio E, Gafner J, Querol A (2006) Natural hybrids from Saccharomyces cerevisiae, S. bayanus and S. kudriavzevii in wine fermentations. FEMS Yeast Res 6, 1221–1234
Krieger-Weber S, Heras JM, Suarez C (2020) Lactobacillus plantarum, a New Biological Tool to Control Malolactic Fermentation: A Review and an Outlook. Beverages 6, 23
Leroy F, De Vuyst L. (2004). Lactic acid bacteria as functional starter cultures for the food fermentation industry. Trends Food Sci Technol 15, 67–78
Libkind D, Hittinger CT, Valério E, Gonçalves C, Dover J et al (2011). Microbe domestication and the identification of the wild genetic stock of lager-brewing yeast. Proc Nat Acad Sci, 108(35), 14539-14544
Liu SQ (2002) A review: Malolactic fermentation in wine — Beyond deacidification. J Appl Microbiol 92, 589–601
Lorentzen MPG, Lucas PM (2019) Distribution of Oenococcus oeni Populations in Natural Habitats. Appl Microbiol Biotechnol 103, 2937–2945
Jolly NP, Varela C, Pretorius IS (2014) Not your ordinary yeast: non-Saccharomyce yeasts in wine production uncovered. FEMS Yeast Res, 14, 215–237
Makarova K, Slesarev A, Wolf Y, Sorokin A, Mirkin B et al. (2006) Comparative genomics of the lactic acid bacteria. Proc Natl Acad Sci U S A. 103:15611–15616
Marcobal AM, Sela DA, Wolf YI, Makarova KS, Mills DA (2008) Role of hypermutability in the evolution of the genus Oenococcus. J Bacteriol 190, 564-570
Margalef-Català M, Araque I, Weidmann S, Guzzo J et al. (2016) Protective roles of glutathione addition against wine-related stress in Oenococcus oeni. Food Res Internat 90, 8-15
Marsit S, Mena A, Bigey F, Sauvage F, Couloux A. et al. (2015) Evolutionary advantage conferred by an eukaryote-to-eukaryote gene transfer event in wine yeasts. Mol Biol Evol 32, 1695–1707
Ono J, Greig D, Boynton PJ (2020) Defining and Disrupting Species Boundaries in Saccharomyces. Ann Rev Microbiol 74,477-495
Padilla B, Gil JV, Manzanares P (2016) Past and future of non-Saccharomyces yeasts: from spoilage microorganisms to biotechnological tools for improving wine aroma complexity. Front Microbiol 7, 411
Pérez-Ortı́n JE, Querol A, Puig S, Barrio E (2002) Molecular Characterization of a Chromosomal Rearrangement Involved in the Adaptive Evolution of Yeast Strains. Genome Res 12, 1533-1539
Steensels J, Gallone B, Voordeckers K, Verstrepen KJ (2019) Domestication of industrial microbes. Curr Biol 29 R381 (Review)
Sipiczki M (2008) Interspecies hybridization and recombination in Saccharomyces wine yeasts. FEMS Yeast Res 8, 996-1007
Steensels J, Snoek T, Meersman E, Picca Nicolino M et al (2014) Improving industrial yeast strains: exploiting natural and artificial diversity. FEMS Microbiol Rev 38, 947–995
Yang D, Woese CR (1989) Phylogenetic structure of the ‘‘Leuconostocs’’: an interesting case of a rapidly evolving organism. Syst Appl Microbiol 12, 145–149
Zheng J, Wittouck S, Salvetti E et al (2020) A taxonomic note of the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostococaceae. Int J Syst Evol Microbiol 004107
La microbiota fecal desvetlla que els miners de Hallstatt fa 2700 anys tenien una dieta variada, incloent formatge blau i cervesa
1 nov 2021
Click here for the English version: Faecal microbiota from 2700 years
Fa pocs dies vaig llegir aquesta notícia al New Scientist (Wong 2021) que em va atraure de seguida: Minaires –o miners– de l’edat del ferro bevien cervesa i menjaven formatge blau i això s’ha comprovat gràcies als seus excrements fecals. Bé, em va atraure, com podeu suposar no tant per motius escatològics fisiològics –he he–, com per això del consum de cervesa i formatge blau a la prehistòria. Vaig trobar la mateixa notícia pels mateixos dies a altres publicacions digitals de divulgació científica mitjançant les xarxes socials, com per exemple a Cell Press (2021).
La notícia sintetitza –molt– un treball recentment publicat al Current Biology per un grup d’investigadors (Maixner et al 2021), sobretot del Tirol italià i d’Àustria, que han fet un estudi molt complet de mostres de femtes prehistòriques –paleofemtes– de les mines de sal de Hallstatt, a Àustria, per tal de conèixer la dieta i nutrició, i també la microbiota intestinal d’aquests miners (Figura 1).
En llegir l’article de Maixner, de seguida va augmentar el meu interès perquè toca diverses àrees que fa temps que m’interessen: a) la història i evolució de les diferents poblacions humanes; b) la microbiota intestinal; i c) els aliments fermentats i els diversos microorganismes implicats.
L’estudi multidisciplinari inclou anàlisis detallades de microscòpia, metagenòmica i proteòmica d’aquestes mostres. En concret les mostres de paleofemtes de 1-2 cm (vegeu l’aspecte a la Figura 2) són de 1300-1100 aC (edat del bronze), de 600-500 aC (edat del ferro) i de 1720-1780 dC, o sigui del segle 18. Les datacions han estat fetes amb radiocarboni 14C.

Perquè les mines de sal de Hallstatt ?
Hallstatt és un bonic petit poble a les vores d’un llac alpí a l’alta Àustria, a uns 80 km de Salzburg, a la regió de Salzkammergut (Figura 3). Com veiem, els topònims fan referència a la sal, per la importància històrica d’aquesta en l’economia de la regió. El poble és conegut sobretot per l’anomenada “cultura de Hallstatt”, el període final de l’edat del bronze (1200-800 aC) i inicial de l’edat del ferro (800-500 aC.), que es desenvolupà sobretot al centre d’Europa, a les conques altes del Rin i el Danubi.
La cultura de Hallstatt es caracteritza per l’ús avançat del treball amb metalls, ferro sobretot, i l’agricultura. Eren pobles indoeuropeus, societats tribals avançades, precursors dels celtes, i amb molt de comerç amb els pobles mediterranis. A Hallstatt hi han les mines de sal, explotades des del 1400 aC, i hi ha nombrosos enterraments d’aquesta cultura, amb molts objectes d’ús quotidià i ornamentals. L’àrea de Hallstatt-Dachstein fou declarada patrimoni cultural per la UNESCO.

Les mines subterrànies de sal de Hallstatt són de les més antigues conegudes (Figura 4), amb un registre continu d’explotació, i ofereixen unes condicions ideals de preservació. Vegeu el lloc web de la visita al museu de les mines a https://www.salzwelten.at/en/hallstatt. L’elevada concentració de sal i la temperatura constant de 8ºC a l’interior de les galeries aïllades preserven molt bé els materials orgànics relacionats amb els humans.
Des del segle 19 els arqueòlegs han estat treballant a Hallstatt, i a més de 2000 tombes protohistòriques a l’entorn del poble, a les mines s’han excavat capes denses de diversos metres de residus, descobrint milers d’eines de fusta i elements de construcció, instruments fets amb pell, centenars de fragments tèxtils de llana, herba, cordes i excrements humans, com els de les mostres d’aquest estudi.

La microbiota fecal dels miners
Per estudiar la microbiota fecal, les mostres de paleofemtes han estat tractades per Maixner et al (2021) per extreure el DNA i generar-ne biblioteques gèniques per seqüenciació multiplex amb una plataforma Illumina. Els quasi 300 milions de lectures obtingudes de seqüències de DNA han estat analitzades i comparades amb les bases de dades del NCBI per tal de conèixer la taxonomia de les espècies microbianes i d’altres.
Considerant l’edat de les mostres, el DNA danyat ha estat excepcionalment baix. Aquesta preservació tan bona probablement és deguda a la ràpida dessecació de les mostres a les mines de sal, que redueix molt el dany hidrolític de les biomolècules. La majoria del DNA identificat correspon a bacteris, un 79 a 94%, essent Firmicutes i Bacteroidetes els fílums més abundants.
De les 15 espècies més abundants identificades a les mostres (Figura 5), n’hi ha 13 que són freqüentment associades a la microbiota intestinal humana. Una de les dues “alienes” és Halococcus morrhuae, un arqueu halòfil, que normalment viu en altes concentracions de sal, i que probablement s’incorporà a partir dels cristalls de sal que envoltaven la mostra. L’altra no usual als humans sans és Clostridium perfringens, conegut patogen alimentari que causa fortes diarrees. Però com que aquest fet no s’ha detectat a les mostres, és probable que fos un contaminant, segons els autors. Com veiem a la mateixa Figura 5, les espècies identificades han estat comparades en quant a la seva prevalença en mostres actuals de poblacions no-occidentalitzades i occidentalitzades, entenent per “no-occ…” les d’estil de vida no urbanitzat, dieta amb menjar poc processat i molta fruita i verdura, higiene senzilla, i accés limitat a l’assistència sanitària i productes farmacèutics.
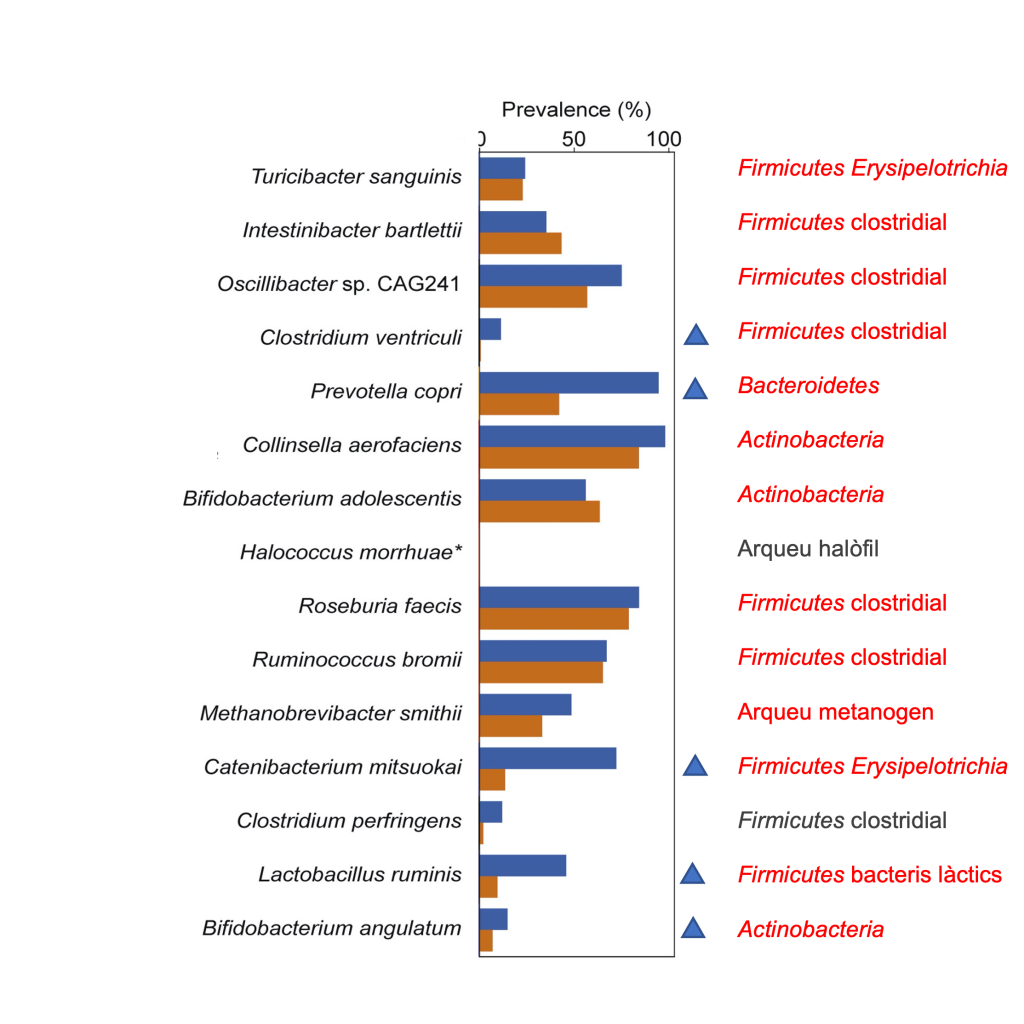
Entre les 13 espècies trobades com a més abundants, n’hi ha 8 Firmicutes (5 clostridials, 2 Erysipelotrichia i 1 lactobacil), 1 bacteroidal (Prevotella), 3 Actinobacteria incloent-hi 2 bifidobacteris), i 1 metanogen. Cal destacar que 5 d’aquestes més abundants són de les predominants a la microbiota de poblacions actuals no-occidentalitzades, senyalades amb triangle blau a la Figura 5. El cas més rellevant és Prevotella, el bacteroidal ben conegut en poblacions no occidentalitzades amb dietes més riques en carbohidrats i menys en proteïnes i greixos animals (vegeu el meu post sobre Bacteroides), que en les mostres de paleofemtes és al voltant del 7%. Prevotella copri en particular s’associa amb la digestió de carbohidrats complexes, components majoritaris d’una dieta vegetal rica en fibra i no processada. També és rellevant la presència de 2 bifidobacteris i un lactobacil, bacteris sovint relacionats amb productes làctics i probiòtics.
No hi ha gaire diferències entre les microbiotes de les mostres de l’edat de ferro, les del segle 18 i les de poblacions actuals no occidentalitzades. Això concorda amb què la dieta majoritària en tots aquests casos és d’aliments no processats, sobretot cereals, i fruites i verdures fresques. En efecte, en l’anàlisi microscòpica de les paleofemtes s’observen restes d’ordi, blat, mill, llegums i diversos fruits silvestres. La principal diferència en la mostra del segle 18 és que el material vegetal és molt més fi, com si hagués estat més triturat. Això suggereix que els miners protohistòrics devien menjar els cereals i llegums en una espècie de puré mentre que els del segle 18 ho devien fer en forma de pa o galetes.
En analitzar DNA animal, com era d’esperar, en el cas de l’humà, eren tots homes, mascles, els miners és clar. Respecte a altres animals que serien part de la dieta, se n’ha trobat de boví i porcí, en totes les mostres.
I menjaven formatge blau i bevien cervesa ?
Sembla que sí. Bé, de fet no ens hauria d’estranyar. Els humans coneixen i elaboren aliments fermentats (vegeu el meu post del 5 març 2021) sobre el concepte d’aliments fermentats) des de fa alguns milers d’anys. En quant als formatges i llets fermentades, és molt probable que amb la revolució neolítica agrícola en diferents llocs fa més 10000 anys (vegeu el meu post del 26 desembre 2012) ja s’aprofités la llet de diversos animals domesticats i s’elaboressin aquests productes fermentats, més duradors que la llet i més digeribles que aquesta. En quant a la cervesa, està ben registrat que els antics egipcis i mesopotamis ja n’elaboraven, en principi com a subproducte dels cereals, fa uns 6000 anys.
El treball de Maixner et al (2021) amb les paleofemtes té el mèrit de demostrar aquest consum a partir de la microbiota fecal, per part d’aquests miners de Hallstatt. En l’anàlisi metagenòmica del DNA present a les mostres han estudiat també els fongs, i han trobat sobretot en una de les mostres de l’edat del ferro (del 600 aC, fa 2600 anys) una gran abundància (fins a un 20% del DNA eucariòtic) de Penicillium roqueforti i de Saccharomyces cerevisiae, així com proteïnes d’aquests fongs a l’estudi proteòmic. Els autors han confirmat que aquests fongs són d’origen antic perquè els nivells de DNA danyat són semblants als del DNA humà endogen de les mateixes mostres. Com que P. roqueforti s’utilitza per a la fermentació de formatges i S. cerevisiae és el llevat present a l’elaboració de cervesa i vi, es pot suposar que aquests identificats haurien estat implicats en el processat d’aquests aliments d’aquella època. Per confirmar-ho, els autors han recorregut a reconstruir els genomes i fer filogènia comparativa amb soques actuals de diferents procedències.
Amb això, han vist que aquests P. roqueforti de les paleofemtes de l’edat del ferro s’assemblen genèticament a les soques de formatges blaus però no a les de Roquefort en concret. Per tant, aquests miners devien elaborar formatges blaus no-Roquefort. Malgrat la semblança, les soques modernes presenten molts fragments de soques d’altres formatges, resultat de transferència genètica horitzontal (TGH), relacionada amb la selecció i encreuaments a què han estat sotmesos, mentre que les de l’edat de ferro no presenten signes de TGH.
El suggeriment de què aquests miners consumien formatges blaus té un bon recolzament pel fet que avui dia s’elaboren amb una aplicació de sal a la superfície, fins a un 7%, la qual cosa era ben factible a l’entorn de mines de sal. El quallat i elaboració del formatge serien fetes en recipients de fusta com els trobats a les mateixes mines (Figura 6). Aquests formatges blaus, a banda d’aportar nous aromes i textures, tenen els avantatges –com la majoria de formatges i llets fermentades– de molt llarga caducitat i baix contingut en lactosa, la qual cosa afavoreix la digestió, sobretot en pobles amb baixa tolerància, com devia ser el cas en aquella època.

En el cas de les S. cerevisiae, les de l’edat del ferro han estat comparades amb 157 soques actuals de pa, cerveses, vins, sake, bioalcohols, de laboratori i silvestres. En una primera anàlisi s’ha constatat que les de les paleofemtes s’assemblen més a les de vi i cervesa, i són ben diferents de les silvestres. Per tant, eren soques ja domesticades en l’elaboració de begudes alcohòliques. En una PCA (Figura 7) s’ha vist més similitud amb S. cerevisiae de cerveses actuals, en concret d’un grup de cerveses (beer 2), més properes a les del vi. Les anàlisis d’alguns gens marcadors i la proteòmica també han confirmat que les soques antigues estaven relacionades amb la fermentació alcohòlica, sigui de cerveses o de vins.
La proposta de que fossin S. cerevisiae de cerveses també lliga amb les anàlisis de la dieta, amb abundància de cereals, com en altres cultures i civilitzacions protohistòriques, com els sumeris i egipcis més o menys des del 3000 aC, força abans que aquestes mostres de les mines de sal.
Bé, tot plegat, aquest és un treball molt interessant que per un costat confirma que els humans elaboren aliments fermentats des de fa alguns milers d’anys, i per altre costat, demostra l’efectivitat dels mètodes moleculars més innovadors per identificar microorganismes de la microbiota, en aquest cas per la bona conservació de les mostres gràcies a la sal. Com sabeu, el protagonisme de la sal al llarg de la història li ha conferit un caràcter quasi sagrat i certament carregat de simbolisme.
Bibliografia
Cell Press (2021) “Ancient feces shows people in present-day Austria drank beer and ate blue cheese up to 2,700 years ago” Science Daily, 13 October. www.sciencedaily.com/releases/2021/10/211013114028.htm.
Maixner F, Sarhan MS, Huang KD, …. 15 ….., Zink KD, Reschreiter H, Kowarik K (2021) Hallstatt miners consumed blue cheese and beer during the Iron Age and retained a non-Westernized gut microbiome until the Baroque period. Current Biology 31, 1-14. https://doi.org/10.1016/j.cub.2021.09.031
Wong C (2021) “Ancient faeces show iron age miners ate blue cheese and drank beer”. New Scientist, 13 October. https://www.newscientist.com/article/2293434-ancient-faeces-show-iron-age-miners-ate-blue-cheese-and-drank-beer/
Aliments fermentats: consens recent sobre aquest concepte
5 març 2021
Click here for the English version: Fermented foods: consensus statement and reviewing them
El terme “aliments fermentats” ha estat molt utilitzat però fins ara no ha tingut una definició clara, hi ha incoherències relacionades amb l’ús del terme “fermentat” i a vegades s’utilitza incloent productes més o menys relacionats, com els probiòtics. Tot i que aquests aliments s’han consumit durant milers d’anys, darrerament reben una atenció creixent entre biòlegs, nutricionistes, altres científics i consumidors.
Per tal de desenvolupar-ne una definició i descriure el paper dels aliments fermentats en la dieta humana, l’Associació Científica Internacional de Probiòtics i Prebiòtics (ISAPP) va convocar el setembre de 2019 a un grup d’experts per fer-ho de forma consensuada. La ISAPP és una organització sense ànim de lucre, dirigida per científics i acadèmics, i encara que és finançada per empreses, les seves activitats no estan estipulades per la indústria. La seva missió és proporcionar informació objectiva i científica sobre probiòtics, prebiòtics i altres temes relacionats amb la nutrició i la salut.

Figura 1. Portal d’internet de l’Associació Científica Internacional de Probiòtics i Prebiòtics (ISAPP)
Aquests experts del ISAPP han estat un total de 13, procedents dels USA, Irlanda, Canadà, Bèlgica i Corea S., la majoria de centres universitaris i alguns d’empreses, i les seves conclusions han estat publicades recentment (Marco et al 2021).
Una de les principals conclusions del consens al que han arribat és la mateixa definició: aliments i begudes fermentats són els elaborats mitjançant el creixement microbià desitjat, el qual comporta conversions enzimàtiques dels components dels aliments. En aquest treball, a banda de repassar quins són, també defineixen la distinció entre aliments fermentats i probiòtics, tracten el coneixement actual sobre seguretat, riscos i beneficis d’aquests aliments, i finalment en revisen la regulació i la possibilitat d’incloure’ls a les directrius dietètiques dels diferents països.
Què són els aliments fermentats ?
Els humans van aprendre fa alguns milers d’anys a consumir i elaborar aliments fermentats, probablement en paral·lel al desenvolupament de l’agricultura i la ramaderia. Vegeu per exemple el meu article sobre formatges i llets fermentades fets fa 7000 anys.
El consum d’aliments fermentats es va estendre i promoure des dels inicis a totes les civilitzacions sobretot perquè és una de les maneres més efectives de conservar aliments, degut a la formació de compostos que inhibeixen altres microbis perjudicials i/o patògens. Entre aquests compostos produïts pels microorganismes que fan la fermentació destaquen els àcids orgànics (com el làctic o l’acètic), l’etanol o les bacteriocines. Només cal recordar per un costat tots els productes lactis derivats de la llet que es conserven més temps que la llet gràcies a l’àcid làctic produït pels bacteris dels formatges, iogurts, etc. I per un altre costat, el consum de cerveses o vins com una bona alternativa més higiènica en llocs i èpoques on no es disposava d’aigua corrent no contaminada. La major perdurabilitat dels aliments fermentats encara té molta importància avui dia en regions pobres del món on no hi ha prou seguretat alimentària o on no hi ha gaire accés a l’electricitat, la refrigeració o l’aigua neta.
Altres mètodes de conservar aliments són la disminució de l’activitat aquosa (aw) mitjançant l’addició de sal o sucre o l’assecat, l’addició de compostos inhibidors (per ex. espècies o el fumat), fer el buit, i els tractaments tèrmics (fred o calor), entre altres.
L’altre motiu del consum d’aliments fermentats és l’aparició de noves qualitats organolèptiques, de gustos, olors o textures agradables i diferents, degut a les transformacions bioquímiques dels microorganismes en la composició de l’aliment.
Els aliments fermentats són una part important de la dieta humana, fins i tot en regions desenvolupades on la seguretat alimentària i la conservació dels aliments estan ben controlades. S’ha estimat que actualment es produeixen i consumeixen globalment més de 5000 varietats d’aliments (i begudes) fermentats (Tamang et al 2016).
Així doncs, en l’esmentada definició de consens de l’ISAPP queda ben clar que els aliments fermentats són aquells elaborats de forma volguda pels humans on cal l’activitat dels microorganismes i on aquests duen a terme una sèrie de reaccions enzimàtiques dels components de l’aliment.
Encara que els enzims endògens o exògens, procedents de plantes, animals o altres fonts, també poden estar presents en aquests aliments, aquesta activitat no és suficient per ser considerat com aliment fermentat, ja que cal l’activitat microbiana.
D’altra banda, la principal diferència amb els aliments deteriorats per microorganismes és que aquests aliments ho són de manera no volguda i els fermentats ho són deliberadament i controladament per generar-ne qualitats desitjables.
També cal puntualitzar que als aliments fermentats l’acció dels microorganismes no sempre és mitjançant el metabolisme de fermentació. Efectivament, des del punt de vista bioquímic, “fermentació” és un tipus de metabolisme on la font d’energia i tant el donador com l’acceptor d’electrons són compostos orgànics (sobretot carbohidrats), on els ATP es sintetitzen per fosforilació de substrat (per exemple a la glucòlisi) i no hi ha formació d’ATP per fosforilació oxidativa amb cadenes de transport d’electrons lligada a membranes, com seria el cas de la respiració (Figura 2). Molts aliments fermentats clàssics ho són per metabolisme fermentatiu com la fermentació làctica o l’alcohòlica, però també es consideren aliments fermentats alguns on els microorganismes estan fent respiració aeròbica, com els bacteris acètics del vinagre o les floridures d’alguns formatges. Per tant el terme “aliments fermentats” té una visió més ampla, independent del metabolisme, on només cal la intervenció activa i volguda de microorganismes.

Figura 2. Reaccions principals dels mecanismes bàsics de síntesi d’ATP: Fosforilació oxidativa per cadenes transportadores d’electrons (dalt) i Fosforilació a nivell de substrat (baix).
Quins són els aliments fermentats i els microorganismes implicats ?
En trobem una bona relació a nivell mundial al treball de Tamang et al (2016), amb els microorganismes que hi intervenen, resumits a la Taula 1. Naturalment aquest article no és una relació exhaustiva, ja que per exemple hi trobem a faltar la sobrassada balear, si bé apareix la “soppressata” siciliana, probablement relacionada en origen. Veiem alguns dels aliments fermentats més coneguts a la Figura 3.
Taula 1. Tipus d’aliments fermentats i els microorganismes implicats (resumit de Tamang et al (2016)
| Tipus | Productes | Països | Microorganismes |
| Llets fermentades i derivats | Iogurts, formatges, sèrum de mantega (buttermilk), quefir, kumis, leben, etc. Són de vaca i també de molts altres mamífers, com ovella, cabra, euga, camella, iac i búfala | Tot el món | Bacteris làctics Alguns bifidobacteris Alguns llevats Floridures (Penicillium) |
| Productes vegetals (fruits, talls, bulbs, fulles, arrels, llegums) fermentats | Olives, col àcida (sauerkraut), kimchi, molt diversos confitats de raves, albergínies, cebetes, pastanagues, fermentats de la mandioca, productes de la soja (salsa de soja, miso, natto, tempeh). Vins (veure a baix) | Tot el món | Bacteris làctics Bacillus i altres firmicutes Llevats Algunes floridures (Rhizopus) |
| Altres fermentats derivats de vegetals | Vinagre, té fermentat com la kombutxa, i cacau fermentat per fer xocolata | Tot el món | Bacteris acètics Llevats |
| Carns fermentades | Embotits com xoriço, peperoni, salsitxes, sobrassada | Tot el món, sobretot Europa | Bacteris làctics Altres firmicutes Alguns llevats |
| Peix i salses de peix fermentat | Molt diversos, ex. nuroc mam, nam pla Garum | Àsia orientalAntiga Roma | Bacteris làctics Altres firmicutes Altres bacteris |
| Begudes alcohòliques de cereals produïdes amb cultius amilolítics fúngics | Sake | Japó | Aspergillus oryzae Llevats |
| Begudes alcohòliques de cereals produïdes amb saliva humana | Txitxa (chicha) | Sudamèrica | Saliva Llevats Bacteris làctics i altres |
| Begudes alcohòliques de cereals (ordi, blat, etc) amb maltatge | Cerveses | Tot el món | Llevats Alguns bacteris làctics |
| Begudes alcohòliques de parts de plantes | Pulque de l’agave | Mèxic | Bacteris làctics Zymomonas Llevats |
| Begudes alcohòliques de fruites | Vins de vinya | Totes les regions de clima temperat | Llevats Oenococcus (ferm. malolàctica) |
| Begudes alcohòliques de la mel | hidromel tej | Sobretot món antic Etiopia | Llevats Bacteris làctics |
Com veiem a la Taula 1, els principals microorganismes de molts aliments fermentats des de les llets a carns i vegetals i altres, són els bacteris làctics. Són bacteris grampositius del fílum Firmicutes (amb baix G+C al DNA), no formadors d’espores, anaerobis aerotolerants, i considerats com a segurs. Altres bacteris responsables d’alguns aliments fermentats són els Bacillus (Firmicutes esporulats), altres Firmicutes com Staphylococcus, bacteris del fílum Actinobacteris (grampositius amb alt G+C al DNA) com Bifidobacterium, Propionibacterium i Brevibacterium. Dins els pocs bacteris gramnegatius que hi trobem, veiem que destaquen els acètics (del fílum Alfaproteobacteris) i també cal esmentar a Zymomonas, del mateix fílum. Podeu veure la ubicació filogenètica de tots aquests bacteris dins el meu post “Bacteris: 21 fílums principals, amb 147 gèneres importants“.
A la mateixa Taula 1 veiem que a banda dels bacteris, sobretot els làctics, els altres microorganismes més importants són els llevats, sobretot Saccharomyces, fongs ascomicets unicel·lulars. Altres fongs agents actius en aliments fermentats són sobretot alguns dels filamentosos, com els també ascomicets Penicillium i Aspergillus, i el zigomicet Rhizopus.

Figura 3. Diversos aliments fermentats: sobrassada, formatges, formatge blau, iogurt, olives, salsa de soja, cervesa i vi.
Microorganismes vius o morts als aliments fermentats ?
Els microorganismes que han intervingut activament en l’elaboració dels aliments fermentats poden estar presents i viables, o sigui vius, en alguns d’aquests i en canvi en altres són absents perquè se’ls ha separat de l’aliment o aquest ha tingut un tractament, normalment tèrmic, que els ha eliminat (Marco et al 2021).
Entre els aliments fermentats que contenen microorganismes vius podem esmentar el iogurt, quefir i altres llets fermentades, la majoria de formatges, miso, natto i tempeh, molts dels productes vegetals fermentats que no se’ls ha tractat tèrmicament com les olives, molts dels embotits, la kombutxa, i algunes cerveses.
Els aliments fermentats on s’han eliminat o apartat els microorganismes són per ex. el pa, els productes vegetals fermentats tractats tèrmicament, la salsa de soja, el vinagre, els vins, la majoria de cerveses, i les faves de cafè i de cacau un cop torrefactes.
En molts aliments fermentats sense inocular, o sigui amb la microbiota espontània pròpia, hi ha més d’un microorganisme responsable dels canvis que es duen a terme des de l’aliment original al fermentat. Sovint hi ha una successió de tipus de microorganismes, en funció de la composició de l’aliment i de les condicions ambientals a les que és sotmès: sal, temperatura, sequedat, etc. Per exemple, a la fermentació de les olives de taula primer predominen llevats i altres bacteris, i finalment s’acaben imposant els bacteris làctics.
Diferències respecte als probiòtics
Encara que a vegades els aliments fermentats són etiquetats o nomenats com “probiòtics” o que “contenen probiòtics”, cal deixar clar que no és el mateix i ni molt menys és així en la majoria dels casos. El terme probiòtic només és correcte utilitzar-lo quan s’ha demostrat algun efecte beneficiós per a la salut del consumidor del producte, i que aquest efecte és degut a un microorganisme viu present i ben caracteritzat. Aquest benefici sobre la salut és més enllà dels beneficis nutritius de la matriu de l’aliment que el conté. Per això, els termes “aliment fermentat” i “probiòtic” no poder ser utilitzats un per l’altre.
En el cas d’aliments fermentats que poden contenir algun microorganisme probiòtic, amb efectes demostrats sobre la salut, només hauria de ser etiquetat amb “conté probiòtics” en el cas que el microorganisme probiòtic estigués ben caracteritzat a nivell de soca i que estigués en quantitats significatives al llarg de la vida útil de l’aliment.
Els aliments fermentats i la seguretat alimentària
Els aliments fermentats augmenten la seguretat de l’aliment per al consumidor, en el sentit que hi és més difícil el creixement d’organismes perjudicials o patògens que respecte als aliments originals abans de fermentar. En efecte, sovint contenen quantitats notables d’àcids orgànics, com àcid làctic produït pels bacteris làctics o l’acètic fet pels bacteris homònims. Molts d’aquests productes al mateix temps tenen baixa activitat d’aigua, i contenen sal i altres antimicrobians, amb la qual cosa són coneguts com a segurs des de fa molt temps (Adams & Mitchell 2002). De manera semblant, les begudes que continguin >4% etanol o pH < 4.5 també són considerades microbiològicament segures.
A més, molts bacteris làctics, siguin autòctons o inoculats, produeixen bacteriocines que inhibeixen altres bacteris indesitjables, com Listeria o Clostridium.
Alguns aliments fermentats també incrementen la seguretat en eliminar compostos tòxics o antinutritius dels aliments crus, com és el cas de moltes fermentacions de cereals, llegums i tubercles. Per exemple, la mandioca conté glicòsids cianogènics que són eliminats a la fermentació per Lactobacillus plantarum (Lei et al 1999). També, a la fermentació de la massa mare (sourdough) alguns bacteris làctics faciliten la degradació mitjançant l’enzim fitasa (una fosfatasa) de l’àcid fític present als cereals, que és un quelant de cations divalents (Ca, Mg, Fe, Zn) i per tant disminueix la seva adsorció (López et al 2001).
A més, es pot afirmar que, amb molt poques excepcions, els microorganismes protagonistes dels aliments fermentats, bàsicament bacteris làctics, llevats i fongs filamentosos, no són patògens ni produeixen compostos tòxics o perjudicials. De fet, molts d’ells, com els mateixos bacteris làctics, però també força altres (com alguns Bacillus, Figura 4) són considerats GRAS per la FDA dels USA (generalment reconeguts com a segurs, en anglès) o QPS per la EFSA europea (presumpció qualificada de seguretat, en anglès).

Figura 4. Un dels últims ingredients declarats GRAS per la FDA dels USA és justament un Bacillus subtilis que també pot ser utilitzat en aliments fermentats. Tret de US FDA Gras Notices.
Tanmateix, cal sempre tenir molta cura, com en qualsevol tipus d’aliment, cal assegurar-se que els ingredients són frescos i segurs, evitar-ne qualsevol alteració, i tenir uns bons controls al llarg del procés d’elaboració i en el producte acabat, comprovant que no hi hagi cap contaminació dels habituals patògens alimentaris.
Alguns aliments fermentats contenen compostos que poden comportar riscos de seguretat alimentària si son consumits en excés. Aquest és el cas de les begudes alcohòliques, que cal prendre amb molta moderació pels efectes de l’etanol, i cal evitar el seu consum en persones de risc. Per un motiu diferent i no relacionat amb els microorganismes, també cal no consumir en excés els aliments fermentats que contenen sal, com la salsa de soja o el kimchi.
Uns dels pocs compostos produïts pels bacteris làctics que cal controlar són les amines biògenes, que es poden trobar en petites quantitats en aliments fermentats com formatges, embotits, alguns vegetals i el vi, i que poden produir diversos problemes de salut i sobretot migranyes. Cal minimitzar-ne la seva producció controlant els possibles productors i inoculant soques no productores.
Les micotoxines com aflatoxines, ocratoxines i moltes altres, són la principal preocupació dels aliments fermentats amb fongs filamentosos com Aspergillus i Penicillium dels fermentats de soja, formatges i altres (Sivamaruthi et al 2019). Tanmateix, en la majoria d’aquests productes s’utilitzen soques seleccionades, bé per domesticació al llarg de segles o bé més recentment per selecció artificial, que no produeixen toxines.
Beneficis del consum d’aliments fermentats sobre la salut nutritiva humana
Més enllà dels motius de preservació d’aliments i les qualitats organolèptiques, hi ha certes evidències epidemiològiques que suggereixen que les dietes riques en aliments fermentats poden reduir el risc de malalties i augmentar la longevitat, la salut i qualitat de vida. Però aquestes dietes, com pot ser la dieta mediterrània, inclouen altres aliments a banda dels fermentats, i per tant no és segur que els efectes positius siguin deguts als aliments fermentats. A més, amb l’excepció del iogurt i altres llets fermentades, s’han fet pocs estudis clínics ben dissenyats i controlats sobre els possibles beneficis dels aliments fermentats sobre la salut en quant a malalties concretes (Marco et al 2021).
Tanmateix, els efectes indirectes sobre la salut dels aliments fermentats són ben patents quan es consideren els aspectes nutritius. L’activitat microbiana dona lloc a l’enriquiment i/o eliminació de diversos compostos que afecten i milloren la composició nutritiva del producte final.
En primer lloc, els microorganismes redueixen el contingut de sucres altament calòrics, monosacàrids i disacàrids, presents a les llets, carns i vegetals. Això permet reduir l’índex glucèmic i disminuir la intolerància de l’aliment, com la lactosa dels lactis, els fructans del blat, o la rafinosa i estaquiosa dels llegums. Amb la fermentació s’hidrolitzen polisacàrids, proteïnes i greixos, la qual cosa facilita la digestió, i com s’ha comentat, s’eliminen diversos compostos tòxics o antinutritius com l’àcid fític.
En el cas dels aliments que contenen polifenols, s’ha comprovat que els lactobacils augmenten la biodisponibilitat de flavonoides, tanins i altres compostos bioactius. És ben coneguda la biosíntesi de vitamines, derivats d’aminoàcids, àcids orgànics com l’esmentat àcid làctic, pèptids i cofactors per part dels microbis que fermenten els aliments (Melini et al 2019).
S’ha vist que molts dels microorganismes vius dels aliments fermentats poden sobreviure el trànsit gàstric i arribar al còlon, ja que per exemple molts bacteris làctics són tolerants al pH àcid i les sals biliars i s’ha comprovat que poden arribar a mantenir-se transitòriament al còlon (Elli et al 2006). Encara que és improbable que aquests microorganismes sobrevisquin gaire temps, s’ha vist que sí que poden ser metabòlicament actius al tracte gastrointestinal, i que aquesta colonització a curt termini seria suficient per produir compostos bioactius, inhibir patògens i influir positivament en el sistema immunitari. Aquests efectes són incrementats si hi ha un consum diari i repetit de l’aliment fermentat.
També s’ha vist que els aliments fermentats, i els microorganismes que contenen, influeixen en la composició de la microbiota intestinal pròpia (Taylor et al 2020). Vegeu també González et al 2019 i Le Roy et al 2020. Un altre factor positiu addicional en el cas d’aliments fermentats vegetals és que força components d’aquests són prebiòtics i per tant afavoreixen la microbiota intestinal.
A més, cal tenir en compte la importància del que mengem, i en aquest cas dels aliments fermentats, en relació al sistema immune, ja que en els humans i altres mamífers el 70% d’aquest sistema es troba al tracte gastrointestinal i els aliments són la principal font de contacte entre els antígens externs i el nostre cos. Això és particularment important en els nadons i la colonització microbiana inicial del digestiu. La ingesta d’aliments fermentats durant els primers anys de la infància s’ha associat amb un risc reduït d’atòpia (predisposició genètica a les al·lèrgies) infantil (Alm et al 1999). Per a qualsevol edat, sembla que els microorganismes dels aliments fermentats i els seus components, com per ex. glucopèptid, proteïnes de superfície, exopolisacàrids, lipoteïcoic, o el D-fenil-làctic dels bacteris làctics (Peters et al 2019), són beneficiosos per al sistema immune, sobretot més demostrat en les llets fermentades (Bourrie et al 2016; Foligne et al 2016).
A la Figura 5 veiem un esquema dels mecanismes bàsics dels possibles beneficis dels aliments fermentats.

Figura 5. Mecanismes bàsics dels beneficis dels aliments fermentats per a la salut, sobretot del punt de vista nutritiu, amb les transformacions dels components dels aliments en substàcies bioactives. SCFA són els àcids grassos de cadena curta. Tret de Marco et al 2021.
Finalment, per acabar només comentar que malgrat que els aliments fermentats són consumits arreu del món i que compten aproximadament per 1/3 de la dieta humana, normalment són absents com a aliments recomanats en les guies de dietes (Marco et al 2021). També és una llàstima que la majoria d’informació que surt als mitjans o a les revistes de divulgació o a les xarxes socials sobre aquest tipus d’aliment és exagerat o erroni, sovint fent-los sinònims dels probiòtics.
Bibliografia
Adams M, Mitchell R (2002) Fermentation and pathogen control: a risk assessment approach. Int. J. Food Microbiol. 79, 75–83
Alm J S, Swartz J, Lilja G, Scheynius A, Pershagen, G (1999) Atopy in children of families with an anthroposophic lifestyle. Lancet 353, 1485–1488
Bourrie B C, Willing B P, Cotter P D (2016) The microbiota and health promoting characteristics of the fermented beverage kefir. Front Microbiol 7, 647
Elli M et al (2006) Survival of yogurt bacteria in the human gut. Appl Environ Microbiol 72, 5113–5117
Foligne B et al (2016) Immunomodulation properties of multi-species fermented milks. Food Microbiol 53, 60–69
González S et al (2019) Fermented dairy foods: impact on intestinal microbiota and health-linked biomarkers. Front Microbiol 10, 1046.
Iraporda C. et al (2015) Lactate and short chain fatty acids produced by microbial fermentation downregulate proinflammatory responses in intestinal epithelial cells and myeloid cells. Immunobiology 220, 1161–1169
ISAPP, The International Scientific Association for Probiotics and Prebiotics: https://isappscience.org
Lei V, Amoa-Awua WK, Brimer L (1999) Degradation of cyanogenic glycosides by Lactobacillus plantarum strains from spontaneous cassava fermentation and other microorganisms. Int. J. Food Microbiol. 53, 169–184
Le Roy C I et al (2020) Red wine consumption associated with increased gut microbiota α-diversity in 3 independent cohorts. Gastroenterology 158, 270–272
López HW et al (2001) Prolonged fermentation of whole wheat sourdough reduces phytate level and increases soluble magnesium. J. Agric. Food Chem. 49, 2657–2662
Marco ML, Sanders ME, Gänzle M et al (2021) The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods. Nature Rev Gastroenterol Hepatol. https://www.nature.com/articles/s41575-020-00390-5
Melini F, Melini V, Luziatelli F, Ficca AG, Ruzzi M (2019) Health-promoting components in fermented foods: an up-to-date systematic review. Nutrients 11, 1189
Peters A et al. (2019) Metabolites of lactic acid bacteria present in fermented foods are highly potent agonists of human hydroxycarboxylic acid receptor 3. PLoS Genet. 15, e1008145
Sivamaruthi BS, Kesika P, Chaiyasut C (2019) Toxins in fermented foods: prevalence and preventions – A mini review. Toxins 11, 4
Tamang JP, Watanabe K, Holzapfel WH (2016) Review: Diversity of microorganisms in global fermented foods and beverages. Front Microbiol 7, 377
Tarvainen M, Fabritius M, Yang B (2019) Determination of vitamin K composition of fermented food. Food Chem 275, 515–522
Taylor B C et al (2020) Consumption of fermented foods is associated with systematic differences in the gut microbiome and metabolome. mSystems 5, e00901-19
BACTERIS: 21 fílums principals, amb 147 gèneres importants
Click here for the English version: “BACTERIA, 21 main phyla, with 147 important genera”
16 maig 2023 ACTUALITZACIÓ de versió 7 abril 2020
CANVIS en la nomenclatura dels fílums, i de Lactobacillus
Des que el 2020 vaig escriure aquest article hi han hagut 2 revisions importants en la nomenclatura taxonòmica dels bacteris, i procariotes en general:
En primer lloc, just pel març 2020 es va publicar (Zheng et al. 2020) la proposta de reclassificació i nomenclatura taxonòmica de l’extremadament divers gènere Lactobacillus, en base sobretot a la filogènia de les seqüències genòmiques completes de la majoria de les fins aleshores 261 espècies incloses. Amb la proposta, ara són 25 gèneres, i espècies molt conegudes han canviat el nom del gènere mantenint el d’espècie, com Levilactobacillus brevis, Lacticaseibacillus casei, Lactiplantibacillus plantarum, Limosilactobacillus reuteri o Latilactobacillus sakei. Alguns s’han mantingut amb el mateix nom de gènere, com Lactobacillus acidophilus, Lactobacillus delbrueckii o Lactobacillus helveticus. A la proposta també s’ha inclòs l’anterior família de Leuconostocaceae dins les Lactobacillaceae.
L’altre revisió important, i fins a cert punt més costosa d’admetre, és la publicació l’octubre 2021 (Oren & Garrity 2021) d’una nota taxonòmica dels nous noms de 42 fílums, amb uns canvis importants aplicats a les regles del International Code of Nomenclature of Prokaryotes, de tal manera que els noms dels fílums acabin en -ota, en base al gènere tipus. Amb això, ara els Firmicutes són Bacillota, els Actinobacteria són Actinomycetota, els Bacteroidetes són Bacteroidota, els Deinococcus-Thermus són Deinococcota, els Tenericutes són Mycoplasmatota, els Proteobacteria són Pseudomonadota, els Verrucomicrobia són Verrucomicrobiota, i així successivament.
A les Figures de moment encara he mantingut els noms antics dels fílums, i al llistat a continuació he afegit els noms nous darrera els antics.
—————————————————
Si voleu anar directament a l’arbre filogenètic simplificat (Figura 4) que proposo més a baix, cliqueu aquí. Ídem per a la relació dels 21 fílums. Ídem per al llistat alfabètic de gèneres.
Propòsit d’aquest article
Més d’un cop alguns alumnes m’han comentat que quan a classe o en fer algun treball bibliogràfic, els apareix un nom d’un gènere microbià que no els és gaire familiar, no tenen clar on trobar quin tipus de microorganisme és i/o quines són les seves característiques bàsiques, a banda de recórrer a la Wikipedia o Viquipèdia. Encara que n’hi ha abundant bibliografia, i per a consultes només d’ubicació filogenètica d’un determinat gènere jo faig anar l’apartat Taxonomy del National Center for Biotechnology Information (NCBI), a mi mateix em passa que sovint trobo a faltar una font d’informació que sigui fàcil i ràpida de consultar, i que no caldria que fos massa exhaustiva.
Aquest és el propòsit d’aquest article del meu blog: fer un resum dels principals fílums bacterians, amb la relació dels gèneres més importants. Aquests són els que semblen més rellevants, sobretot per aspectes beneficiosos, a nivell ambiental o en aliments i altres aplicacions industrials, també alguns pels seus metabolismes característics, i també alguns dels patògens més coneguts.
Per no fer-ho massa exhaustiu, de moment aquí em limito als bacteris, i per tant no es consideren ni arqueus, ni microorganismes eucariotes, ni virus.
Taxonomia i filogènia dels Bacteris
La taxonomia és la ciència d’anomenar, definir i classificar els grups de sers vius en base a les característiques que comparteixen. Aquests grups són els tàxons, que es distribueixen en categories jerarquitzades, que són (variables segons els organismes): Domini, Regne, Fílum (SCB 2009-210), Classe, Ordre, Família, Gènere i Espècie. Com sabeu, el primer sistema taxonòmic fou desenvolupat al segle 18 per Carl von Linné, que establí els fonaments de la nomenclatura binomial (Gènere + espècie).
Després de Linné, la taxonomia es desenvolupà gràcies sobretot a Ernst Haeckel (segle 19) i Robert Whittaker, que va proposar els 5 regnes: els 4 eucariotes (Animals, Plantes, Fongs i Protistes) més el dels Monera, els procariotes, bacteris bàsicament (Whittaker 1969).
Encara que es podrien establir classificacions taxonòmiques només en base a les característiques fenotípiques (morfologia, estructures, metabolismes, etc.), actualment la taxonomia s’elabora veient les relacions de parentesc entre els organismes i la seva història evolutiva, o sigui la filogènia, realitzant arbres filogenètics, que es basen en les semblances genètiques, que expliquen l’evolució dels organismes, tant els actuals com els extingits.
Històricament, abans dels coneixements moleculars, la classificació o taxonomia dels bacteris va presentar moltes dificultats i errors, donades les seves dimensions microscòpiques i la manca de trets morfològics fàcils de distingir, al contrari de plantes i animals. La classificació es basava només en la forma, estructura de la paret cel·lular (Gram) i els metabolismes, però no es podia realitzar un arbre filogenètic.
Això va canviar de la mà de Carl Richard Woese (1987), iniciador de la revolució filogenètica molecular, que va classificar tots els organismes (no només els bacteris), en base a les seqüències del RNA ribosòmic, definint per primer cop els arqueobacteris (ara Archaea o arqueus), i per tant introduint el concepte dels tres dominis (Figura 1).

Figura 1. Arbre filogenètic universal dels 3 dominis (Archaea o Arqueus (SCB 2009), Bacteris i Eucariotes), determinat comparant les seqüències dels rRNA, on les llargades de les línies són proporcionals a les distàncies calculades per alineament dels rRNA (Woese 1987).
Limitant-nos als Bacteris, en base al 16S rRNA Carl Woese n’establí 11 divisions (Figura 2).
Figura 2. Arbre filogenètic dels bacteris determinat comparant les seqüències dels rRNA 16S, on les llargades de les línies són proporcionals a les distàncies calculades per alineament dels 16S i el punt d’origen és una seqüència consens dels arqueus (Woese 1987).
Després de Woese, a nivell de bacteris aquest arbre filogenètic s’ha anat modificant, per una banda incorporant-hi nombrosos grups de bacteris descoberts, sobretot termòfils, quimiolitòtrofs i altres d’ambients extrems. I d’altra banda, el desenvolupament de les tècniques no dependents de cultiu ha permès detectar nombrosos bacteris sense haver d’aïllar-los. Entre aquestes tècniques on es pot analitzar directament el DNA de mostres ambientals, cal senyalar els mètodes de metagenòmica, que amplifiquen i seqüencien fragments dels gens (16S o altres) de tots els bacteris presents i es tracten les dades amb programes bioinformàtics per comparar uns amb altres i deduir les possibles noves espècies.
Coetàniament a Woese, la classificació de tots els sers vius va ser millorada per Thomas Cavalier-Smith, sobretot a nivell dels protistes (Cavalier-Smith 1993). Alguns dels arbres recents més complets de bacteris s’han basat en comparar alguns gens més conservats, com Lang et al (2016), que proposa diferents models de superarbres de 3000 procariotes seqüenciats en base a 24 gens.
En base a tot això, un dels arbres filogenètics més recents és el proposat per Hug et al. (2016), que ha estat elaborat en base a les seqüències publicades, incloses les dades genòmiques de 1000 organismes poc coneguts i no aïllats en cultius. Aquest “arbre de la vida” amb els 3 dominis de bacteris, arqueus i eucariotes revela una predominança de la diversificació bacteriana i subratlla la importància d’organismes dels quals no es tenen representants aïllats (Figura 3). Per a aquest arbre foren utilitzats 30437 genomes d’espècies dels 3 dominis disponibles a les bases de dades del NCBI pel setembre 2015. Actualment (març 2020) ja consten 50159 espècies seqüenciades al NCBI: 1724 arqueus, 26467 bacteris, 4915 eucariotes i 17053 virus.

Figura 3. Visió actual de l’arbre de la vida, englobant la diversitat total de genomes seqüenciats, amb 92 fílums bacterians, 26 d’arqueus i els 5 supergrups eucariotes (Hug et al. 2016)
En anar comparant les seqüències genètiques de molts bacteris s’ha anat veient la dificultat d’elaboració dels arbres filogenètics evolutius amb branques com sempre els representem, perquè la transferència genètica horitzontal (TGH) és un fenomen habitual als bacteris. Mitjançant els mecanismes de transformació, transducció vírica i conjugació, els bacteris comparteixen molts gens en la seva evolució, i desdibuixen les branques, de tal manera que la representació hauria de ser més semblant a una xarxa. Per tant, cal prendre’s les representacions dels fílums en branques evolutives com una aproximació relativa.
El recurs bibliogràfic més important per a la determinació, identificació i sistemàtica de tots els organismes procariotes, o sigui Bacteris i Arqueus, ha estat sens dubte el Manual Bergey. Iniciat el 1923 per David H. Bergey, lògicament ha tingut successives actualitzacions i ampliacions, mantenint la importància de ser el Manual de referència per a la descripció de totes les característiques dels procariotes. La darrera versió publicada en paper del Bergey’s Manual of Systematic Bacteriology comprèn 5 volums en 7 llibres (2001-2012). Més recentment s’ha publicat una versió online (Whitman, 2015).
Un altre recurs valuós és la base de dades LPSN (List of Prokaryotic Names with Standing in Nomenclature) (Parte 2014), que recull el llistat online de tots els noms dels procariotes que han estat validats per publicació al International Journal of Systematic and Evolutionary Microbiology, sota les regles del Codi Internacional de Nomenclatura de Bacteris. Actualment, a la LPSN hi han llistats 15974 tàxons, distribuïts en 41 fílums bacterians més 5 d’arqueus. A més, la LPSN inclou la classificació actualitzada dels procariotes, la seva nomenclatura, i de les col·leccions de cultiu.
Tanmateix, tant el Bergey com el LPSN són massa exhaustius i poc pràctics per fer una cerca ràpida d’algun gènere bacterià concret, o tenir una visió ràpida global de les relacions filogenètiques entre diversos fílums.
La meva proposta simplificada de l’arbre filogenètic dels Bacteris
En base a l’arbre comentat de Hug et al (2016) (Figura 3), limitant-nos als bacteris, he gosat fer-ne una simplificació, prescindint dels fílums no gaire coneguts o de les nombroses branques sense representants aïllats en cultiu. Amb això, queden els 21 fílums principals que veiem a la Figura 4.
Com he comentat al principi (16 maig 2023) els noms del fílums s’han canviat (Oren & Garrity 2021) i ara acaben tots en -iota en base al nom del genus tipus. Els canvis més manifestos són per exemple Firmicutes per Bacillota, i Proteobacteria per Pseudomonadota. A les Figures encara no he canviat els noms antics, però al llistat que vé a continuació he afegit als noms nous al darrera els antics.
……………
Com veiem a la Figura 4, Terrabacteria i Hydrobacteria són dues categories taxonòmiques superiors que inclouen la gran majoria de fílums bacterians, el 99% de bacteris. Els Terrabacteria haurien evolucionat adquirint adaptacions de resistència a condicions ambientals terrestres com dessecació, radiació UV, alta salinitat, incloent una paret cel·lular característica (grampositius) i altres d’ells haurien desenvolupat la fotosíntesi oxigènica (els cianobacteris). Els Hydrobacteria serien la resta de bacteris, la majoria de gramnegatius, que haurien evolucionat en ambients aquosos o humits, i inclouen els 2 superfílums FCB (Fibrobacter–Chlorobi–Bacteroides) i PVC (Planctomyces–Verrucomicrobia–Chlamydia), i el gran grup de Proteobacteris. Els supertàxons Terrobacteria i Hydrobacteria haurien divergit fa 3000 milions d’anys, quan els Terrabacteria haurien començat a colonitzar els continents.
A la mateixa Figura 4 he senyalat els protomitocondris i protocloroplasts, que van sorgir dels fílums Alfaproteobacteria i Cyanobacteria respectivament, fa uns 1500-2000 milions d’anys.

Figura 4. Visió actual simplificada de l’arbre filogenètic dels bacteris amb 21 principals fílums, elaborat en base al conjunt de seqüències del DNA de 16 proteïnes ribosomals (modificada de Hug et al 2016). LUCA: últim avantpassat comú universal (Last Universal Common Ancestor).
——————————
RELACIÓ dels 21 FÍLUMS principals dels bacteris: característiques i gèneres més importants
Com he comentat al principi (16 maig 2023) els noms del fílums s’han canviat (Oren & Garrity 2021) i ara acaben tots en -iota en base al nom del genus tipus. En aquest llistat he conservat els noms antics i he afegit els nous noms.
A continuació descric mínimament els 21 fílums (Figura 4), seguint l’arbre filogenètic de dreta a esquerra. Per als tàxons (classes, ordres) més rellevants que comento dins d’algun dels fílums, he seguit les categories tal com estan al NCBI (Taxonomy). He resumit les descripcions en base a les fonts bàsiques d’informació de Microbiologia, com el Brock (Madigan et al. 2017), Lengeler et al. (1999), Tortora et al. (2018), o el Prescott (Willey et al. 2017), i dins dels recursos més habituals d’internet, a més de la Wikipedia, també cal senyalar el MicrobeWiki.
1. Aquificae = Aquificota
Com Aquifex o Hydrogenobacter, és un fílum proper a Thermotogae, i ambdós són els bacteris més propers als arqueus. Són bacils gramnegatius, hipertermòfils, quimiolitòtrofs aerobis, oxiden H2 produint H2O, i es troben en aigües calentes o volcàniques.
2. Thermotogae = Thermotogota
Com Thermotoga, és un fílum proper a Aquificae. Són hipertermòfils, anaerobis fermentatius, bacils gramnegatius, amb un embolcall tipus “toga”, i es troben en aigües calentes i xemeneies hidrotermals.
3. Deinococcus – Thermus = Deinococcota
És un fílum de bacteris molt resistents a ambients extrems, per tant extremòfils, que inclou 2 grups dels quals els gèneres més coneguts són els que donen nom al fílum:
Deinococcus són cocs grampositius amb paret gruixuda, amb segona membrana, resistents a raigs gamma i UV, de color rosa pel pigment carotenoide deinoxantina.
Thermus són bacils gramnegatius hipertermòfils, es troben en fonts termals, i també al compostatge. Th. aquaticus fou aïllat per Thomas D. Brock (el del llibre) i H. Freeze, de les aigües termals amb guèisers de Yellowstone, i és molt conegut per la DNA-polimerasa Taq, molt utilitzada a les PCR perquè no es desnaturalitza a 95ºC. Th. thermophilus, també amb DNA-polimerases termostables, és un model per a la manipulació genètica.
4. Cyanobacteria = Cyanobacteriota
Els cianobacteris abans eren coneguts com “algues verd-blaves” o cianofícies, perquè són filamentosos i fan fotosíntesi, com les algues i les plantes. Com aquestes, fan fotofosforilació no cíclica, amb 2 fotosistemes i clorofil·la. De fet, són l’origen evolutiu dels proto-cloroplasts, van “inventar” la fotosíntesi oxigènica, són els únics bacteris que la fan actualment, i van generar l’atmosfera tal com la coneixem fa uns 2700 milions d’anys. Els estromatòlits fòssils formats per biopel·lícules de cianobacteris són els indicis més antics de vida a la Terra. Són filaments gramnegatius, amb membranes internes. Alguns fixen N2 en cèl·lules especialitzades (heterocists) més gruixudes que contenen la nitrogenasa. Són a molt diversos hàbitats, tant terrestres com aquàtics, alguns són simbionts de plantes, altres fan cianotoxines, i són els principals causant de blooms en aigües eutròfiques. Alguns són menjar, font de nutrients (Spirulina). Amb metabolisme secundari molt actiu, també són font interessant d’antivirals, antibiòtics i antitumorals. Altres gèneres són: Anabaena, Chroococcus, Nostoc, Oscillatoria, Pleurocapsa i Synechococcus.
5. Firmicutes = Bacillota
Són un gran fílum de grampositius, bacils o cocs, quimioheteròtrofs, amb baix contingut de G+C al DNA (la majoria amb <50%). Inclou sobretot 3 grans classes, Bacilli, Clostridia i Negativicutes:
Bacilli amb 2 ordres, Bacillales i Lactobacillales:
Bacillales, que són aerobis o facultatius, amb respiració aeròbica sobretot. Gèneres importants:
Bacillus, bacils formadors d’endòspores, ubics als ambients terrestres, on junt amb Paenibacillus afavoreixen els conreus vegetals (vegeu el meu post sobre l’agromicrobioma). L’esporulat més resistent és B. stearothermophilus, model dels càlculs d’esterilització tèrmica. Cal destacar-ne els patògens B. anthracis (àntrax maligne o carboncle) i B. cereus (intoxicacions alimentàries). Moltes espècies són d’interès industrial: producció d’enzims (com amilasa) o proteases (subtilisina de B. sutilis), antibiòtics peptídics, alguns són probiòtics d’aus (vegeu el meu post sobre Bacillus probiòtics), i B. thuringiensis és molt utilitzat com a bioinsecticida per les seves toxines Cry i els seus gens incorporats en plantes modificades genèticament Bt (cotó, moresc i altres).
Listeria, bacils anaerobis facultatius no formadors d’endòspores, sapròfits però també patògens oportunistes (L. monocytogenes) i resistents al fred, són la primera causa de mort entre les malalties de transmissió alimentària.
Staphylococcus, cocs anaerobis facultatius agrupats en forma de raïm, habituals comensals a la pell i mucoses membranoses. Alguns són patògens degut a la formació de coagulasa.
Lactobacillales: són els bacteris làctics (BL) o de l’àcid làctic. Vegeu la nota inicial afegida pel maig 2023 sobre la reclassificació, en base a Zheng et al. (2020). Són bacils o cocs, anaerobis aerotolerants, amb metabolisme fermentatiu, produint sobretot àcid làctic a partir de sucres. No esporulats, són presents en plantes en descomposició (sobretot Lactobacillus) i als productes lactis (sobretot Lactococcus, Lactobacillus i Streptococcus). Són molt importants industrialment, com a agents actius de molts aliments fermentats (derivats de llets, vegetals, carns, peixos, vins i cerveses, etc.), coneguts en conjunt com a productes làctics, on aquests bacteris contribueixen a conservació, per baixada del pH i producció de bacteriocines, i qualitats organolèptiques. Per això són globalment considerats com a GRAS (Generally Recognized as Safe). A més, també tenen un paper rellevant a la microbiota saludable animal i humana, tant al digestiu com a les superfícies mucoses. Per això alguns d’ells són dels probiòtics més usuals, sobretot Lactobacillus. D’altra banda, Oenococcus és el gènere exclusiu dels vins, on du a terme la fermentació malolàctica (aquí teniu un petit resum), una fermentació peculiar lligada a ATPasa. Altres gèneres importants de BL són: Enterococcus (alguns poden ser patògens i altres probiòtics), Leuconostoc, Pediococcus (present a cerveses, vegeu el meu post sobre BL de cerveses), Weissella, Carnobacterium, Aerococcus i Fructobacillus.
Clostridia
Són bacils anaerobis estrictes formadors d’endòspores. Són sapròfits, fermentant sobretot polisacàrids vegetals, i viuen sobretot als sòls. Alguns són patògens oportunistes freqüents al digestiu (Clostridium difficile) o sapròfits de teixits que poden causar gangrena (C. perfringens) i els pitjors produeixen algunes de les toxines més perilloses: C. tetani i C. botulinum. En canvi, són molt abundants a la microbiota intestinal saludable (vegeu el meu post) i per tant possibles probiòtics (Clostridium, Eubacterium, Coprococcus i Ruminococcus, productors dels beneficiosos butirat i propionat), i sobretot Faecalibacterium prausnitzii o Christensenella, associats a baix índex corporal i poc greix.
Encara que de la mateixa classe Clostridia i també anaerobis esporulats, el gènere Heliobacteria són fotoheteròtrofs anoxigènics (amb bacterioclorofil·la g, un fotosistema i fotofosforilació cíclica), no són grampositius i fixen N2.
Negativicutes
Són anaerobis esporulats, propers filogenèticament als Clostridia, però gramnegatius, ja que tenen una membrana externa semblant a la dels proteobacteris (possible transferència genètica horitzontal). Selenomonas té forma de mitja lluna, és mòbil, present al rumen dels remugants. Veillonella és un coc de l’intestí humà, beneficiós perquè fermenta lactosa donant acetat i propionat. Phascolarctobacterium i Megasphaera són bacils pleomòrfics que també produeixen aquests àcids grassos de cadena curta a l’intestí, i per tant, també beneficiosos.
6. Tenericutes = Mycoplasmatota
Fílum proper als Firmicutes, però no tenen paret cel·lular. Classe única: Mollicutes. Són molt petits de mida (0,2-0,3 µm), i de genoma (0,6 Mbp), perquè són paràsits intracel·lulars d’animals i plantes, sapròfits i/o patògens. En no tenir paret cel·lular, són resistents a molts antibiòtics. De forma variable, poden viure sense oxigen. Els Mycoplasma són patògens humans que poden causar pneumònia o infeccions de transmissió sexual.
7. Chloroflexi = Chloroflexota
Com Chloroflexus, també són anomenats bacteris verds no-sofre o clorobacteris, són filamentosos o lliscants, amb membranes internes (clorosomes). Són fotoheteròtrofs anoxigènics (amb bacterioclorofil·la cs, un fotosistema i fotofosforilació cíclica). Són gramnegatius però sense membrana externa. La classe Thermomicrobia inclou els que són termòfils (Thermomicrobium), alguns amb pigment rosa.
8. Actinobacteria = Actinomycetota
Són un altre gran fílum de grampositius, heteròtrofs, tant aerobis com anaerobis, amb alt contingut de G+C al DNA (la majoria amb >50%), de formes irregulars i alguns filamentosos. Són molt versàtils catabòlicament i ubics a ambients terrestres i aquàtics. Inclou aquests ordres principals:
Actinomycetales, com Actinomyces, són anaerobis facultatius, poden fer endòspores, són filamentosos però alguns bacils. Són uns dels microorganismes econòmicament més importants als sòls, tant agrícoles com forestals. Descomponen la matèria orgànica, juntament amb els fongs, als quals s’assemblen perquè formen micelis filamentosos.
Bifidobacteriales, anaerobis, fermenten carbohidrats, són bacils irregulars, sobretot bífides, ex. Bifidobacterium. Són importants a la microbiota intestinal de mamífers, als humans sobretot als infants, utilitzats com a probiòtics.
Corynebacteriales, aerobis, bacils més o menys irregulars, alguns en forma de porra i altres a vegades fan hifes. Abundants en diferents ambients terrestres, alguns són importants industrialment com a productors d’aminoàcids, com glutàmic i lisina (Corynebacterium glutamicum). Altres són patògens: C. diphtheriae, Mycobacterium tuberculosis (vegeu el meu post), M. leprae, i alguns oportunistes de baixa virulència com Nocardia.
Frankiales, filamentosos, com Frankia, viuen simbiòticament fixant N2 en nòduls a les arrels de molts tipus d’angiospermes.
Micrococcales, amb gèneres com: Micrococcus, cocs presents en aigües i sòls, sapròfits i oportunistes, útils per a biodegradació de contaminants, i alguns en productes càrnics, amb cists molt resistents (vegeu el meu post sobre persistència de microbis); Cellulomonas, bacils del sòl degradadors de cel·lulosa gràcies a glucanases; Arthrobacter (sinònim Siderocapsa) són bacils i cocs aerobis comuns al sòl, alguns per a producció de glutàmic i per a bioremediació, s’han descrit fins i tot alguns degradadors del polímer niló, i el seu DNA és dels més persistents al permafrost, més de 300.000 anys (vegeu el meu post ). Brevibacterium linens és ubic a la pell humana, produeix tioèsters típics de pudor de peus, i a més s’utilitza a formatges (Munster, Limburger, etc).
Propionibacteriales, com Propionibacterium, bacils anaerobis que sintetitzen propiònic a partir de sucres i també d’àcid làctic. També poden utilitzar el fumarat per una fermentació peculiar amb ATPasa. Presents a la microbiota intestinal i la pell d’animals, alguns són els causants de l’acne humana (reclassificats com Cutibacterium acnes) (vegeu també el meu post sobre bacteris de l’acne a la vinya). Altres són importants per a la producció de vitamina B12 i als productes lactis, sobretot formatges com els suïssos amb “ulls” (Emmental i altres).
Streptomycetales, amb l’important gènere Streptomyces, són els Actinobacteria més coneguts, amb més de 500 espècies. Aerobis, formen un complex miceli d’hifes ben desenvolupades i es dispersen amb espores aèries a partir d’estructures comparables als fongs micelials, però procariotes. Abundants al sòl i vegetació en descomposició, produeixen geosmina i 2-metilisoborneol, que donen el característic olor “de terra”, compostos que atrauen invertebrats els quals ajuden als bacteris a dispersar les seves espores. Tenen un complex metabolisme secundari, i per això són molt importants industrialment: antibiòtics antibacterians (estreptomicina, neomicina, tetraciclina, etc.), antifúngics (nistatina), antiparasitaris, anticancerosos i també per a l’expressió heteròloga de proteïnes eucariòtiques.
9. Fibrobacteres = Fibrobactecterota
Ja dins els Hydrobacteria (Figura 4), junt amb Chlorobi i Bacteroidetes són el superfílum FCB, abans anomenats com a fílum Sphingobacteria per Cavalier-Smith. Són bacils gramnegatius anaerobis estrictes. Inclouen uns dels principals bacteris cel·lulolítics del rumen dels remugants, com Fibrobacter. Degraden sobretot beta-glucans, produint formiat, acetat i succinat.
10a. Chlorobi = Chlorobiota
Del superfílum FCB, es consideren un sol fílum junt amb Bacteroidetes. Són sobretot els bacteris verds del sofre, bacils o cocs gramnegatius, anaerobis estrictes fotoautòtrofs que fan la fotosíntesi anoxigènica, amb bacterioclorofil·les situades en clorosomes i la membrana plasmàtica. Tenen un fotosistema, i utilitzen sulfurs com donador d’electrons. Capten CO2 pel cicle invers del cítric. Poden produir sulfats o acumular S elemental a l’exterior cel·lular. Chlorobium es troben als fons marins i dels llacs, i són abundants per ex. al Mar Negre.
10b. Bacteroidetes = Bacteroidota
També del superfílum FCB i mateix fílum que Chlorobi, són bacils gramnegatius (amb membrana externa) anaerobis estrictes, no esporulats, exclusius del tracte gastrointestinal d’animals, on són dels bacteris més abundants, sobretot Bacteroides i també Prevotella, i on metabolitzen carbohidrats (polisacàrids sobretot) i altres compostos com les sals biliars, produint àcids grassos de cadena curta, beneficiosos per a l’hoste (vegeu el meu post sobre Bacteroides). Tanmateix, alguns poden ser patògens si passen a òrgans fora del digestiu. Sembla que la ratio Prevotella/Bacteroides en humans és més alta en dietes altes en fibra i menor pes corporal. Flavobacterium és un Bacteroidetes conegut patogen de peixos.
11. Planctomycetes = Planctomycetota
Del superfílum PVC, són bacteris gramnegatius anaerobis particulars, ex. Planctomyces: ovoides amb un apèndix pseudo-tija acabada en una estructura adherent al substrat, amb invaginacions de la membrana que recorden les estructures cel·lulars eucariotes i paret cel·lular amb quasi gens de glicopèptid. Es reprodueixen per gemmació, generant formes flagel·lades lliures que acaben essent sèssils. Viuen en aigües, tant dolces com marines i salobres. Alguns com Brocardia contenen una estructura membranosa, anammoxosoma, on té lloc l’oxidació anaeròbica d’amoni (Anammox) amb nitrit, produint N2, metabolisme important per al cicle del N.
12a. Verrucomicrobia = Verrucomicrobiota
També del superfílum PVC, i considerats del mateix fílum amb Chlamydiae, n’hi ha poques espècies descrites. Tenen formes similars a berrugues i són gramnegatius anaeròbics, aïllats del sòl, aigües i de femta humana. Akkermansia, aerotolerant, a la microbiota de l’intestí humà, s’ha relacionat amb menor obesitat i menor incidència de malalties relacionades, gràcies a mantenir la capa mucosa degradant mucina, contribuint a la funció de barrera.
12b. Chlamydiae = Chlamydiota
També del superfílum PVC i fílum amb Verrucomicrobia, són cocs gramnegatius, obligats intracel·lulars d’eucariotes, molts patògens d’animals i alguns simbionts de protozous. Presenten dues formes (com els virus): l’extracel·lular, particulada o cos elemental, de només 0,3 µm, que per endocitosi genera la forma reticulada intracitoplasmàtica, de 0,5 µm. Les infeccions per Chlamydia són la malaltia bacteriana de transmissió sexual més freqüent.
13. Acidobacteria = Acidobacteriota
Com Acidobacterium, són bacils gramnegatius aerobis o facultatius o anaerobis, heteròtrofs, molts d’ells oligòtrofs, majoria són acidòfils (pH 3-6), i tenen càpsules amb molt d’exopolisacàrid. Encara que són poc aïllats en cultiu, són ubics, especialment als sòls, on arriben a ser el 50% dels bacteris, on molts són simbiòtics a la rizosfera de les plantes. Alguns són bons biodegradadors de compostos aromàtics (Holophaga) i/o captadors de metalls (Geothrix).
14. Nitrospirae = Nitrospirota
Fílum monofilètic, són gramnegatius aerobis de forma helicoïdal o de coma (vibrió). Difícils d’aïllar, són presents en ecosistemes marins formant biofilms però també en terrenys humits o fangs actius de depuradores, biofiltres i altres. És nitrificant, fent oxidació de nitrits, ex. Nitrospira.
“Proteobacteria” = Pseudomonadota i altres
Com veiem a la Figura 4, el nom de gran part dels fílums restants contenen aquest terme. Constitueixen el grup més gran i metabòlicament més divers de bacteris, i tenen en comú ser gramnegatius amb membrana externa de lipopolisacàrids. Són quasi la meitat dels procariotes seqüenciats, i inclouen tant fotòtrofs com heteròtrofs amb un origen evolutiu comú, que se suposa serien fotòtrofs anoxigènics com els bacteris porpra (ex. Rhodospirillum). Per això i per tenir una relació filogenètica en base al 16S, Woese (1987) els va anomenar “Bacteris Porpra i relacionats” i va establir les primeres subdivisions alfa, beta, gamma i delta. Poc després Stackebrandt et al (1988) van proposar aquest terme Proteobacteria, basat en el déu grec Proteu, per l’analogia amb que aquest que podia adoptar múltiples formes.
15a. Deltaproteobacteria = Myxococcota
Considerats fílum comú amb Thermodesulfobacteria, inclouen dos grups:
Els mixobacteris (ordre Myxococcales), aerobis que viuen als sòls, heteròtrofs de matèria orgànica insoluble, que es mouen per lliscament. Tenen genomes molt grans respecte a altres bacteris, de 10 Mbp, algun fins a 16 Mbp. El cicle biològic (Myxococcus per ex.) és complex: les formes vegetatives són bacils lliscants que s’agrupen en cossos fructífers (per quorum sensing de contacte) de diferents formes i colors, i que donen mixòspores esfèriques resistents. Alguns són productors d’antibiòtics i altres com Sorangium, també de fàrmacs antitumorals.
L’altre gran grup són els anaerobis estrictes relacionats amb el sofre. La reducció desassimiladora de sulfats en ambients marins i de depuració d’aigües suposa el 50% de la mineralització de matèria orgànica. Inclou aquests dos ordres:
Desulfovibrionales, els principals bacteris reductors de sulfats: Desulfovibrio, Desulfobacter i altres. Són bacils o bacils corbats flagel·lats que viuen en ambients aquosos, on degraden matèria orgànica, mitjançant la respiració anaeròbia utilitzant sulfat com a acceptor d’electrons. Produeixen SH2, que a més de fer pudor, reacciona amb metalls, els corrou, i produeix per ex. FeS. Són considerats dels microbis més antics a la Terra, i molts importants en el cicle del S.
Desulforomonadales, són els reductors de sofre elemental, també per respiració anaeròbia, però que també poden utilitzar altres compostos inorgànics com nitrat, Fe3+ i altres metalls. També produeixen SH2. Geobacter és un dels principals gèneres, utilitzat per a biodegradació i bioremediació de contaminants, i que s’està estudiant per al disseny de piles microbianes que generin electricitat gràcies a la conductivitat dels biofilms que formen.
15b. Thermodesulfobacteria = Thermodesulfobacteriota
Mateix fílum que els Deltaproteobacteria. Són els reductors de sulfats termòfils i hipertermòfils, bacils aïllats de fonts termals, fons marins i xemeneies hidrotermals. El més conegut, Thermodesulfobacterium, té un lípid de membrana (fosfoaminopentanotetrol) que només es troba als arqueus. Geothermobacterium, aïllat a Yellowstone, té una temperatura òptima de 85-90ºC, la més alta dels bacteris, i redueix Fe3+.
16. Oligoflexia = Bdellovibrionota
Filogenèticament emparentats amb els Deltaproteobacteria, aquest fílum inclou Bdellovibrio i altres depredadors d’altres gramnegatius. Són bacils corbats (vibrions) petits (prop de 1 µm) aerobis, amb un flagel polar que els permet mobilitats de 100 vegades el seu cos per segon. En el seu cicle biològic, la forma lliure mòbil s’adhereix a un bacteri presa, li penetra, forma un complex esfèric amb l’hoste, utilitza hidrolases per digerir proteïnes i DNA de l’hoste, i hi creix en forma de filament, lisa l’hoste i el filament se separa en 3-6 cèl·lules filles lliures, tot en 4 h.
17. Spirochaetes = Spirochaetota
Les espiroquetes són bacteris gramnegatius amb membrana externa, de forma característica espiral o helicoïdal, força llargs (de 3 a 200 µm), degut al filament axial, conjunt de flagels, situat a l’espai periplàsmic. Aquest filament es contrau, permetent la mobilitat. Són heteròtrofs anaerobis o facultatius d’ambients aquàtics diversos. Spirochaeta és de vida lliure i no patogen, però altres gèneres ho són, com Leptospira (leptospirosi), Borrelia (malaltia de Lyme per les paparres) o Treponema (sífilis i malalties tropicals).
18. Epsilonproteobacteria = Campylobacterota, classe Epsiloproteobacteria
Són gramnegatius heteròtrofs, la majoria microaeròfils, mòbils i de formes corbades, espirals o helicoïdals, i els més coneguts són simbionts o patògens al tracte digestiu d’animals, humans inclosos. Campylobacter és patògen sobretot del bestiar, i d’origen alimentari als humans. Helicobacter és molt freqüent a l’estómac causant úlceres i gastritis. Arcobacter és un patogen emergent que a més de trobar-se al digestiu d’animals, pot ser contaminant de mariscs.
El fílum també inclou força aïllats no patògens aïllats de xemeneies hidrotermals i de les fosses submarines, com Sulfurimonas.
19. Alphaproteobacteria = Pseudomonadota, classe Alphaproteobacteria
Gran i molt divers fílum de gramnegatius amb membrana externa a la paret cel·lular. Junt amb betaproteobacteris i gammaproteobacteris constitueixen un clar grup monofilètic, d’origen comú, i serien les Proteobacteria mes típiques (Figura 4). El conjunt dels 3 fílums va ser nomenat com Rhodobacteria per Cavalier-Smith el 1987.
Els alfaproteobacteris inclouen els principals ordres següents:
Rhodobacterales , com Rhodobacter, model d’estudi de la fotosíntesi bacteriana anoxigènica. Són dels anomenats bacteris porpra (pel seu color resultant de les bacterioclorofil·les més els carotens) de no-sofre, per diferenciar-los del porpra de sofre (les Chromatiales dins els gammaproteobacteris). Tenen gran diversitat de metabolismes: fotosíntesi, litotròfia i respiració aeròbia i anaeròbica, i són presents en tots els ambients aquosos.
Rhodospirillales, que inclou també bacteris porpra no-sofre (Rhodospirillum) amb àmplies capacitats metabòliques i forma d’espiral. També ho són els bacteris acètics (Acetobacter, Gluconobacter, Gluconacetobacter, Komagataeibacter i altres), bacils aerobis ben coneguts pel metabolisme oxidatiu respiratori, oxidant sucres i etanol a àcid acètic, produint els vinagres. També ho és Magnetospirillum, microaeròfil de forma espiral, que conté els magnetosomes, orgànuls amb magnetita (Fe3O4), que els permeten orientar-se amb el camp geomagnètic.
Caulobacterales, com Caulobacter, de forma corbada i oligotròfics d’aigua dolça. Tenen un característic cicle cel·lular amb dues formes diferenciades: una amb peduncle adherit a un substrat, que en dividir-se asimètricament genera una forma lliure flagel·lar que acaba passant a forma pedunculada.
Magnetococcales, amb Magnetococcus, cocs marins amb característiques similars a Magnetospirillum, inclosos els magnetosomes.
Rhizobiales, amb Rhizobium, els ben coneguts fixadors de N2 endosimbionts als nòduls radiculars de les lleguminoses. Del mateix ordre són: Agrobacterium, causant de tumors en plantes per transferència del seu DNA, i per això molt utilitzat en enginyeria genètica (A. tumefaciens); Rhodopseudomonas, un altre bacteri porpra fotosintètic no-sofre d’aigües i sòls; Brucella, cocobacils petits patògens d’humans i altres animals; i Nitrobacter, bacils aerobis quimiolitòtrofs nitrificants, oxidant nitrit a nitrat.
Ricketssiales, són endosimbionts obligats de cèl·lules eucariotes, molts patògens, com Rickettsia, patogen humà pleomòrfic (cocs, bacils, etc.) transmès per artròpodes, i Wolbachia, que infecta moltíssims artròpodes i nematodes. Com he senyalat a la Figura 4, la relació filogenètica suggereix que els mitocondris (endosimbionts) es van desenvolupar a partir d’aquest grup.
Sphingomonadales, com Sphingomonas, bacils aerobis estrictes, amb glicoesfingolípids a membrana externa, enlloc dels lipopolisacàrids dels altres gramnegatius, i amb típiques colònies grogues. Presents a molts diversos ambients, on sobreviuen amb baixes concentracions de nutrients i una versàtil capacitat de biodegradar compostos, inclosos aromàtics i altres tòxics. Per això són usats per a bioremediació, i els seus polímers extracel·lulars (esfingans) són aprofitats a la indústria alimentària. Zymomonas són bacils anaerobis facultatius, amb la característica única entre bacteris de fer fermentació alcohòlica, al pulque mexicà o al vi de palma africà, degradant els sucres a piruvat mitjançant la via Entner-Doudoroff.
20. Betaproteobacteria = Pseudomonadota, classe Betaproteobacteria
Fílum divers, de grups aerobis o facultatius, de formes variades, amb versatilitat metabòlica, tant heteròtrofs com quimiolitòtrofs, i alguns fotòtrofs. Els principals ordres són:
Burkholderiales, la majoria són bacils aerobis mòbils: Burkholderia i Bordetella, patògens d’humans i altres animals; Ralstonia i Achromobacter són corrents als sòls i patògens oportunistes; Alcaligenes també són patògens oportunistes, i alguns produeixen el biopolímer polihidroxibutirat; Oxalobacter excepcionalment és anaeròbic, es troba a la microbiota humana i al rumen dels remugadors, on degrada l’oxàlic, beneficiant a l’hoste, per una fermentació peculiar amb ATPasa; Sphaerotilus natans són filamentosos (fins a 0,5 mm) embeinats heteròtrofs aerobis, presents en aigües contaminades i que impedeixen floculació de fangs actius; Acidovorax, conegut patogen de cultius de cucurbitàcies (carbassa, carbassó, cogombre, síndria, etc.); Ideonella sakaiensis és degradador del plàstic PET (vegeu meu post sobre bacteris que mengen plàstic).
Neisseriales, diplococs aeròbics no mòbils, colonitzen les mucoses de molts animals sense causar danys, i només dos espècies són patògens humans: Neisseria meningitidis i N. gonorrhoeae.
Nitrosomonadales, ordre divers amb uns quants quimiolitòtrofs aerobis bacils, com Nitrosomonas, el més conegut dels nitrificants, que oxida amoni a nitrit, o Thiobacillus, els coneguts bacteris oxidadors de sofre (incolors) i de Fe2+, i Gallionella, bacil helicoïdal i filamentós també oxidador de ferro però microaeròfil. Methylophilus són dels diversos organismes (bacteris i fongs) metilòtrofs, que utilitzen com a substrat compostos C1, com metanol, metà, per tant són beneficiosos al medi ambient. Spirillum són microaeròfils heteròtrofs en forma d’espiral, presents en aigües dolces amb matèria orgànica.
Rhodocyclales, en destaca Zoogloea, bacils aeròbics mòbils que són rellevants als tractaments aerobis d’aigües residuals, on degraden matèria orgànica i ajuden a formar els flocs que sedimenten als fangs actius.
21. Gammaproteobacteria = Pseudomonadota, classe Gammaproteobacteria
L’últim gran fílum de Proteobacteria, gramnegatius amb membrana externa a la paret cel·lular, inclou molts grups importants científicament, mèdicament i ambientalment, amb aquests ordres principals:
Xanthomonadales, bacils aerobis, la majoria són fitopatògens com espècies de Xanthomonas que afecten els cultius de cítrics, tomàquets, arròs i altres, i Xylella a la vinya. Alguns són patògens oportunistes dels humans.
Chromatiales, són els bacteris porpra de sofre (Chromatium, Thiocapsa), que fan la fotosíntesi anoxigènica a partir de sulfurs o tiosulfat, produint sofre. Tenen membranes internes amb bacterioclorofil·la i carotens. Són presents a les zones anòxiques de llacs i altres hàbitats aquàtics com les zones intermareals.
Methylococcales, com Methylococcus, són un altre gran grup de metilòtrofs, que utilitzen metà com a font d’energia i de C, i que és oxidat a formaldehid, que s’assimila pel cicle de ribulosa monofosfat, en membranes internes en forma de discs perpendiculars a la paret cel·lular.
Thiotricales, són sobretot quimiolitòtrofs, amb formes de cocs agrupats en filaments, que acumulen grànuls de sofre. Beggiatoa viu en aigües que contenen H2S, i l’oxida a sofre, però també és heteròtrof. Thiomargarita namibiensis, trobat en sediments marins, és el bacteri més gran mai trobat, fins a 0,7 mm de diàmetre, i acumula S al periplasma i nitrat en vacuoles, ja que també és nitrificant.
Legionellales, amb Legionella, bacils pleomòrfics aerobis, coneguts patògens causants de pneumònia (legionel·losi) i altres malalties respiratòries. La majoria d’infeccions estan relacionades amb torres de refrigeració mal mantingudes.
Oceanospirillales són un grup divers metabòlicament però tots prefereixen o els cal un alt contingut en sal, com Halomonas, bacils aerobis mòbils.
Pseudomonodales inclou molts bacils o cocobacils mòbils (flagel·lació polar) heteròtrofs aerobis estrictes i oxidasa positius. Pseudomonas és un dels gèneres bacterians més ubics a molts hàbitats terrestres i aquàtics, amb alguns patògens de plantes i altres oportunistes dels humans, i força malbaratadors d’aliments. Alguns (P. syringae) faciliten la nucleació de cristalls de gel donant lloc a la congelació de teixits vegetals o la condensació de núvols o la formació de neu artificial (vegeu meu post). D’altra banda, la seva gran i diversa capacitat catabòlica aeròbica fa que siguin útils per a depuració d’aigües residuals i bioremediació d’hidrocarburs i altres compostos orgànics complexos. Azotobacter són cocs o de forma oval, mòbils, que formen cists de paret gruixuda i força llim extracel·lular, de vida lliure als sòls, amb un paper rellevant al cicle del N com a fixadors de N2. Acinetobacter són també comuns als sòls, on mineralitzen compostos aromàtics, i alguns són patògens oportunistes sobretot als hospitals. Moraxella són semblants, comensals de mucoses d’animals però també alguns patògens.
Aeromonadales, com Aeromonas, bacils anaerobis facultatius, semblants morfològicament als Enterobacterales, són presents en ambients aquosos, i causa freqüent de gastroenteritis i altres infeccions per ingestió d’aigües o menjar contaminat.
Vibrionales, són vibrions o cocobacils anaerobis facultatius mòbils, presents en medis aquosos, entre els quals hi ha força patògens d’humans, com Vibrio cholerae, i d’altres animals, sobretot peixos. Tanmateix també inclou la majoria de bacteris bioluminiscents: Photobacterium, Aliivibrio i molts Vibrio, d’ambients marins, molts simbiòtics de peixos i altres animals. La llum produïda (490 nm, color cian, blau-verd) ho és per cromòfors lux-flavina lligats a luciferasa, amb oxigen i una cascada de reaccions reductores d’àcids grassos.
Pasteurellales , són bacils o pleomòrfics, sense flagels, anaerobis facultatius i oxidasa positius (a diferència dels Enterobacterales), comensals de superfícies mucoses d’aus i mamífers, alguns patogens. Pasteurella són pleomòrfics i patògens zoonòtics. Molts Haemophilus són patògens humans i H. influenzae fou el primer organisme amb genoma seqüenciat, pel grup de Craig Venter el 1995.
Enterobacterales, inclou la majoria dels gramnegatius amb membrana externa més coneguts, alguns d’ells patògens. Destaquen els anomenats enterobacteris, família Enterobacteriaceae, entre els quals hi ha simbionts i patògens, sobretot a l’intestí dels animals. Són anaerobis facultatius, fan fermentació àcido-mixta i altres metabolismes, no tenen citocrom c oxidasa, i la majoria són bacils o cocobacils mòbils amb flagel·lació peritrica. Hi destaquen Escherichia coli, segurament el bacteri més conegut i organisme model del coneixement bioquímic, genètic i molecular. Alguns E. coli són patògens, altres oportunistes, molts comensals, i alguns fins i tot beneficiosos membres de la microbiota intestinal, utilitzats com a probiòtics. També són Enterobacteriaceae: Salmonella, patogen intracel·lular de molts animals per endotoxines, causant als humans de febres tifoides, infeccions de transmissió alimentària i altres patogènies; Shigella, patogen d’humans i altres primats, també amb endotoxines, és dels principals causants de diarrees; Yersinia pestis, cocobacil patogen ben conegut per les epidèmies; Klebsiella és ubic a molts ambients, comensal habitual de mucoses i intestí d’humans; Enterobacter són coliformes fecals termotolerants (creix a 44,5ºC), patògens oportunistes i alguns són útils en productes lactis; Citrobacter poden utilitzar citrat com a única font de C, també són ubics a molts ambients, i majoria no són patògens
Del mateix ordre Enterobacterales però d’altres famílies són: Erwinia, patogen de plantes; Hafnia, comensal del tracte gastrointestinal humà, usat com a ferment làctic, i possible probiòtic; Proteus, patogen oportunista; i finalment, Thorsellia, present a microbiota intestinal del mosquit Anopheles, que podria utilitzar-se modificat genèticament contra el mosquit i així prevenir transmissió de malària.
LLISTAT alfabètic de 147 GÈNERES bacterians, amb els Fílums corresponents (noms abans 2021)
(enllaç clicant al fílum)
Aquest no és un llistat fix i estàtic: si us plau, si noteu a faltar algun altre gènere que considereu important, m’ho dieu i l’incorporaré.
Bibliografia
Bacterial phyla, Wikipedia
Bacterial taxonomy, Wikipedia
Cavalier-Smith T (1993) Kingdom protozoa and its 18 phyla. Microbiol Reviews 57, 953-94
Hug LA et al. (2016) A new view of the tree of life. Nat Microbiol. 1, 16048
Lang JM, Darling AE, Eisen JA (2013) Phylogeny of bacterial and archaeal genomes using conserved genes: Supertrees and supermatrices. PLoS ONE 8(4): e62510
Lengeler JW, Drews G, Schlegel HG (1999) Biology of the Prokaryotes. Blackwell Science.
Madigan M, Bender KS, Buckley DH, Sattley WM, Stahl DA (2017) Brock Biology of Microorganisms, 15th ed. Pearson.
MicrobeWiki: https://microbewiki.kenyon.edu/index.php/MicrobeWiki
NCBI, National Center for Biotechnology Information: https://www.ncbi.nlm.nih.gov
Oren A, Garrity GM (2021) Valid publication of the names of forty-two phyla of prokaryotes. Int J Syst Evol Microbiol 71:5056.
Parte AC (2014) LPSN – list of prokaryotic names with standing in nomenclature. Nucleic Acids Research 42, D1, D613-D616.
SCB, Societat Catalana de Biologia, IEC (2009-210). Els plurals d’alguns mots acabats en –us o en –um. Què cal saber, n. 210.
SCB, Societat Catalana de Biologia, IEC (2009-216). La denominació dels arqueus. Què cal saber, n. 216.
Stackebrandt E, Murray RGE, Trüper HG (1988) Proteobacteria classis nov., a name for the phylogenetic taxon that includes the “Purple bacteria and their relatives”. Int J Syst Bact 38, 321-325
Tortora GJ, Funke BR, Case CL, Weber D, Bair W. (2018) Microbiology: an Introduction. 13th ed. Pearson.
Whitman WB, ed. (2015) Bergey’s manual of systematics of archaea and bacteria. ISBN 9781118960608.
Whittaker RH (1969) New concepts of Kingdoms of organisms. Science 163, 150-160.
Wiley J, Sherwood L, Woolverton CJ (2017) Prescott’s Microbiology, 10th ed. McGraw Hill Education.
Woese CR (1987). Bacterial evolution. Microbiological Reviews 51(2): 221–71
Zheng J, Wittouck S, Salvetti E et al (2020) A taxonomic note of the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostococaceae. Int J Syst Evol Microbiol 004107
Els bacteris làctics de les cerveses: els dolents i els bons
18 agost 2018
Click here for the English version: The good and the bad lactic acid bacteria of beers
No és fàcil “viure” a la cervesa
En principi, la majoria de bacteris làctics (BL), i molts altres bacteris i en general molts microorganismes, no ho tenen fàcil per sobreviure dins la cervesa, ni a d’altres begudes alcohòliques com el vi. Com és conegut, això és un dels motius principals pel qual vins i cerveses hagin estat des de l’antigor una de les maneres més segures higiènicament de beure una cosa semblant a l’aigua i que no estigués contaminada, a banda de les aigües bullides, com el té i altres infusions d’herbes.
Els motius de la difícil supervivència dels microorganismes a la cervesa són l’etanol, el pH força àcid (al voltant de 4), l’escassesa de nutrients degut a què els llevats els han assimilat quasi tots, el poc oxigen dissolt, l’alta concentració de carbònic (un 0.5% en pes/volum) i la presència dels compostos derivats de la humulona (Figura 1) del llúpol: els iso-alfa-àcids, fins a 50 ppm, que són microbicides. Tots aquests obstacles fan molt difícil que qualsevol microorganisme hi pugui prosperar. Les cerveses més susceptibles de creixement microbià no desitjat són les que algun dels obstacles o impediments esmentats està esmorteït: cerveses amb pH més alt de 4.5, o amb poc etanol o poc CO2, o amb sucres afegits -que són nutrients-, o amb poca quantitat dels compostos derivats del llúpol (Vriesekoop et al 2012).

Figura 1. La humulona (esquerra) del llúpol es degrada durant l’elaboració de la cervesa a isohumulona (dreta) i altres iso-alfa-àcids, compostos amargs característics i microbicides (Wikipedia; Sakamoto & Konings 2003)
El pH àcid de la cervesa (lleugerament superior al vi) inhibeix molts dels bacteris patògens més coneguts (Figura 2). I els casos que veiem que podrien créixer a aquest pH a prop de 4, són inhibits pels altres factors com l’etanol.
Figura 2. Marges de pH àcid per al creixement de diversos bacteris, comparat amb el pH típic de les cerveses. Tret de Menz et al (2009).
Els bacteris làctics dolents a la cervesa
Malgrat el que acabem de veure, alguns bacteris -concretament alguns dels làctics- han estat capaços d’adaptar-se evolutivament a les condicions estrictes de les cerveses, i hi poden sobreviure i espatllar-les. En concret, les espècies més freqüents com perjudicials per a la qualitat de les cerveses són Lactobacillus brevis i Pediococcus damnosus (Figura 3). La primera és la més freqüent, i pot donar gustos i aromes no desitjats, així com terbolesa al producte final. P. damnosus té l’avantatge de créixer a baixes temperatures, i pot produir també aromes no volguts, destacant-ne el diacetil (Vriesekoop et al 2012). Alguns Pediococcus i Lactobacillus poden adherir-se als llevats, induint que sedimentin, la qual cosa retarda la fermentació (Suzuki 2011).

Figura 3. Lactobacillus brevis (esquerra) i Pediococcus damnosus (dreta) al microscopi electrònic de rastreig.
Alguns Pediococcus també poden ser els responsables de l’aparició d’amines biògenes en algunes cerveses, amb risc per al consumidor. Les amines en certa concentració són tòxiques, poden ser presents en alguns aliments fermentats com formatges, embotits i begudes alcohòliques com vins i cerveses, i es produeixen per descarboxilació d’aminoàcids per part dels BL. El nivell de tiramina i altres amines ha estat utilitzat com a mesura de la qualitat en algunes de les cerveses belgues elaborades amb BL (Loret et al 2005).
A banda d’aquests BL, altres bacteris relacionats amb problemes de contaminació a les cerveses són els acètics com Acetobacter, típicament associats amb l’entrada d’oxigen a l’envasat o a la distribució. Altres bacteris perjudicials són alguns enterobacteris, com Shimwellia pseudoproteus o Citrobacter freundii, que proliferen a les primeres etapes de fermentació, i produeixen butanodiol, acetaldehid i altres compostos aromàtics no desitjats (Vriesekoop et al 2012). Uns altres bacteris perjudicials per a la cervesa, sobretot un cop embotellada, són Pectinatus i Megasphaera, que són anaerobis estrictes, de la família dels clostridis, i poden produir sulfur d’hidrogen i àcids grassos de cadena curta, tots ells desagradables (Suzuki 2011).
Els bacteris làctics bons de les cerveses
Els BL són ben coneguts per ser uns dels microbis que més beneficis aporten al camp alimentari, per una banda com a mitjà econòmic de conservar els aliments, i per altra banda per millorar-ne la qualitat i les característiques organolèptiques. Per això són els principals agents dels aliments fermentats, junt amb els llevats. Hem vist alguns dels beneficis alimentaris dels BL en altres posts d’aquest mateix blog: els formatges prehistòrics, o la microbiota de la llet materna, i fins i tot els bacteris del vi.
Així doncs, els BL també tenen el seu bon paper a la producció de les cerveses: en concret, com veurem tot seguit, en la producció de malt acidulat, i en alguns estils peculiars de cervesa com les Làmbic de Bèlgica i la Berliner Weissbier.
Com sabeu, el malt és la matèria primera per fer cerveses. El cereal és sotmès al procés del maltatge, on els grans del cereal -ordi fonamentalment- es fan germinar, els enzims hidrolitzen el midó a sucres, i tot plegat es cou a continuació, obtenint-ne el most, que és la solució substrat per tal que els llevats fermentin i produeixin l’etanol i el carbònic. L’acidificació del malt, o sigui amb un pH més baix, té els avantatges d’activar molts enzims importants al maltatge, i donar una menor viscositat al malt i per tant a la cervesa final. Encara que l’acidificació es pot aconseguir afegint-hi àcids minerals o l’àcid làctic comercial, sovint es recomana o es legisla que l’acidificació sigui biològica, la qual s’aconsegueix afegint-ne BL. La utilització de cultius iniciadors de BL és un procés relativament nou i a més dels beneficis comentats sobre la qualitat del malt, s’ha demostrat que també inhibeix floridures no desitjades que són un problema real al maltatge i que poden donar micotoxines. Els compostos produïts pels BL que poden inhibir els fongs són el mateix àcid làctic i la baixada de pH conseqüent, algunes bacteriocines, peròxid d’hidrogen, i altres compostos no gaire coneguts com potser alguns pèptids (Lowe & Arendt 2004).
Les soques de BL més utilitzades per acidular el malt són de Lactobacillus amylolyticus aïllats prèviament del mateix malt. Aquestes soques de L. amylolyticus són moderament termòfiles, resistents als compostos derivats de l’humulona, i tenen l’avantatge de ser amilolítics a banda de produir l’àcid làctic, que baixa el pH (Vriersekoop et al 2012).
Les cerveses en la fermentació de les quals intervenen BL, com les d’estils Làmbic i Berliner Weissbier, pertanyen al tipus de cerveses de fermentació espontània. Els altres tipus de cerveses de fermentació controlada són, com sabeu, les més conegudes Ale i les Lager, ambdues inoculades amb llevats específics. Les Ale són les de fermentació alta, on el llevat Saccharomyces cerevisiae utilitzat tendeix a romandre a la superfície i la temperatura de fermentació és per damunt de 15ºC i de 20ºC. Les Lager són les de fermentació baixa, originàries històricament de Baviera, on el llevat S. pastorianus (syn. S. carlsbergensis) tendeix a dipositar-se al fons del fermentador i la temperatura és entre 7 i 13ºC.
Les cerveses belgues Làmbic
Les cerveses belgues tradicionals d’estil Làmbic (neerlandès lambiek o lambik) són les més conegudes en quant a les seves característiques sensorials degudes a l’activitat dels BL. Són tradicionals de Brussel·les mateix i de la regió veïna de Pajottenland, a la vall de riu Zenne, al Brabant flamenc al SW de la capital belga. Un dels pobles d’aquesta vall és Lembeek, que podria ser l’origen del nom d’aquesta cervesa.
Aquestes cerveses flamenques de fermentació espontània representen l’estil més antic de fer cervesa del món desenvolupat, des de fa uns quants segles. Des de fa pocs anys se n’elaboren cerveses semblants a altres països en petites quantitats, i als EEUU des de 2008 se’n produeixen en força quantitat, les anomenades “American coolship ales” (Ray 2014).
Les cerveses làmbiques s’elaboren amb malta d’ordi i un mínim de 30% de blat no maltejat. Al most s’afegeixen els cons d’un llúpol especial, totalment assecats i envellits durant 3 anys. S’hi afegeixen no tant per al seu aroma o amargor, que justament els envellits en tenen menys, sinó com a antimicrobià, per prevenir sobretot el creixement de bacteris patògens gram-positius al brou de fermentació.
També per evitar aquests contaminants i per afavorir la microbiota pròpia de la fermentació làmbica, aquestes cerveses només es produeixen entre octubre i maig, ja que a l’estiu hi ha massa microorganismes perjudicials a l’aire que podrien espatllar la cervesa, i cal baixar la temperatura després de la bullida. L’ebullició del most es realitza de forma intensiva, amb una evaporació del 30%. Després de la bullida, el brou es deixa en dipòsits oberts, i d’aquesta manera hi són adquirits els microorganismes de l’aire presents a les sales de fermentació de la cerveseria, normalment a la part alta de l’edifici, i de l’aire exterior, ja que la tradició diu que cal deixar les finestres obertes. Se suposa que la microbiota captada és específica de la vall del Zenne. Aquests dipòsits oberts són els koelschip en neerlandès (coolship en anglès), com piscines (Figura 4). En ser ben oberts, amb molta superfície (uns 6 x 6 m) i poca fondària (uns 50 cm), afavoreixen la captació dels microbis de la sala i de l’exterior. Una altra finalitat d’aquesta forma és el refredament més ràpid del brou bullit per iniciar la fermentació. Poden ser de fusta, de coure o d’inoxidable més recentment.

Figura 4. Koelschip (en neerlandès) o coolship (en anglès), els dipòsits oberts, com piscines, on s’inicia el procés de la cervesa Làmbic (Brasserie Cantillon, Brussel·les).
El brou “inoculat” d’aquesta manera espontània només es deixa una nit als koelschip, i l’endemà aquest most ja es bombeja a tancs de fermentació on hi serà un any, on el contingut en sucres va baixant, fins a uns 30 g/L. Després es transfereix a barriques de roure de les utilitzades prèviament per a xerès o porto, on es pot arribar a deixar uns dos anys més, a unes temperatures de 15-25ºC. Algunes barriques fa 100 anys que s’utilitzen les mateixes. El producte final és una cervesa tèrbola, d’un groc pàl·lid, amb molt poc carbònic, seca, àcida, amb uns 6-8º d’etanol, que recorda una mica al xerès i sobretot a la sidra, i amb un regust lleugerament agre (Jackson 1999).
En aquest llarg procés de fermentació, fins a 3 anys, com és lògic, hi ha una diversitat en la composició de la població microbiana. En una primera fase hi ha una certa predominança de llevats Kloeckera i sobretot d’enterobacteris durant el primer mes. Al cap de 2 mesos ja predominen Pediococcus damnosus i Saccharomycess pp. i comença la fermentació alcohòlica. Després de 6 mesos de fermentació el llevat predominant és Dekkera bruxellensis (Spitaels et al 2014), o el que és el mateix, Brettanomyces (Kumara & Verachtert 1991), del qual Dekkera és la forma sexual.

Figura 5. Espècies dels aïllats en medis d’agar MRS i VRBG, sobretot enterobacteris i bacteris làctics, al llarg del procés d’elaboració d’una cervesa làmbic. El nombre d’aïllats és entre parèntesis (Spitaels et al 2014).
Veiem (Figura 5) com en concret a partir dels 2 mesos el bacteri predominant és el bacteri làctic P. damnosus. Aquest fou nomenat als primers estudis com “P. cerevisiae“, però aquest nom finalment no fou admès perquè incloïa altres espècies. El recompte d’aquests en MRS és de 104 UFC per mL fins al final de la fermentació. L’acidificació sembla que té lloc ràpidament en la transició de la primera fase a la de maduració, coincidint amb el creixement de P. damnosus, que produeix làctic, encara que Dekkera/Brettanomyces i els bacteris acètics també contribueixen a l’acidificació (Spitaels et al 2014).
En altres assajos amb les American coolship ales (ACA) d’estil làmbic també s’han trobat Lactobacillus spp., i en un estudi metagenòmic (Bukolich et al 2012) amb aquestes ACA s’ha detectat DNA de diversos lactobacil·lals, i al final del procés també s’observa un predomini de Pediococcus (Figura 6, panell C). A la mateixa figura al panell A observem com el fong unicel·lular predominant també és Dekkera/Brettanomyces.

Figura 6. Anàlisis TRFLP (polimorfismes de longituds de fragments de restricció terminal amplificats per PCR) de DNA total extret de mostres del procés de fermentació de cerveses ACA (similars a les làmbic) durant 3 anys, utilitzant encebadors específics per a: llevats (ITS1/ITS4 del 26S rDNA, panell A); bacteris (16S rDNA, panell B); i bacteris làctics (panell C). Les mostres senyalades amb * no donaren amplificació. (Bukolich et al 2012)
Cerveses derivades de les Làmbic: Gueuze, les afruitades i altres
La làmbic bàsica, tal qual, és difícil d’aconseguir, només es troba a uns pocs cafès de Brussel·les i de la zona de producció. De fet, és la base per elaborar les altres, molt més habituals de consumir:
La Faro és una làmbic endolcida amb sucre moré i a vegades amb espècies.
Les làmbic afruitades són les que se’ls ha afegit fruites senceres o xarop de fruites. Poden ser amb cirera agre (kriek), que són les més tradicionals, o amb gerds, préssec, raïm, maduixa, i en ocasions també de poma o pinya o albercoc o altres.
I finalment, les Gueuze, que són escumoses i fàcils de trobar per al consumidor. S’elaboren barrejant làmbiques joves (de 6 mesos a 1 any) amb altres làmbiques més madures (de 2-3 anys) en ampolles de vidre gruixut semblants a les de xampany o cava i es deixen per a una segona fermentació gràcies als sucres romanents del làmbic jove. Això ho hauria començat a fer un alcalde de Lembeek cap al 1870, que era propietari d’una cerveseria i hi va aplicar les tècniques de fermentació en ampolla que feia alguns anys havien donat bon resultat a la Xampanya (Cervesa en català 2012). La paraula gueuze pot tenir el mateix origen etimològic que gist (llevat en neerlandès) i també podria referir-se a que produeix bombolles del carbònic, o sigui, gas (Jackson 1999). Tanmateix, una altra versió històrica seria que a aquesta cervesa li deien “Lambic de chez le gueux” (làmbic de cal pobre) perquè l’esmentat alcalde de Lembeek tenia idees socialistes semblants a les del “Parti des Gueus” (partit dels captaires) que van fundar els calvinistes de Flandes al segle XVI per lluitar contra l’imperi espanyol. I com que cervesa és femení en francès, el femení de gueux és gueuze, vet aquí (Cervesa en català 2012).
En aquesta refermentació en ampolla es mantenen les poblacions de Dekkera/Brettanomyces i de BL, encara que apareixen en poca quantitat altres fongs unicel·lulars com Candida, Hansenula, Pichia o Cryptococcus (Verachtert & Debourg 1999).

Figura 7. Diverses cerveses Gueuze i làmbic afruitades, majoritàriament belgues (Foto de www.swanbournecellars.com.au/).
La Berliner Weissbier (Figura 8) és una altra cervesa relativament semblant a les Làmbic. També és una cervesa feta amb una part important de most de blat, és tèrbola, àcida i amb un 3% d’etanol. És una clàssica de Berlín i el nord d’Alemanya, elaborada des del s. XVI i que fins a finals del s. XIX era la beguda alcohòlica més popular de Berlín, i que els soldats de Napoleó anomenaven el “xampany del nord”. En la fermentació espontània del most intervenen una barreja de Dekkera/Brettanomyces, Saccharomyces i lactobacils heterofermentatius.

Figura 8. La cervesa Berliner Weisse (tret de G-LO, @boozedancing wordpress).
Cerveses tipus làmbic fetes a Espanya
De la mateixa manera que recentment es fan les comentades American Coolship Ales, també se’n fan a molts altres països i en el cas d’Espanya, coincidint amb el gust per les cerveses artesanals, també se n’elaboren de tipus làmbic, sobretot de les afruitades. Segons el portal Birrapedia, actualment se n’elaboren 6 d’aquestes, totes de cireres, de les quals dues a les terres de Lleida, una a Barcelona, una a la Marina Alta d’Alacant, una a la vall del Jerte, i una altra a Astúries.
Resistència dels bacteris làctics de la cervesa als compostos del llúpol
Lactobacils i pediococs, tant els dolents com els bons que hem vist, i altres bacteris contaminants de les cerveses, tenen la capacitat de resistir els compostos del llúpol, que com hem vist són microbicides naturals. Aquesta resistència pot ser deguda a diversos sistemes de defensa, tant actius com passius (Sakamoto & Konings 2003). Els actius inclouen bombes d’eflux, com HorA i HorC, que transporten els iso-alfa-àcids (Figura 1) cap a fora la cèl·lula. HorA ho fa amb despesa d’ATP, i HorC mitjançant la força motriu de protons (Figura 9). Els gens corresponents horA i horC foren trobats originalment a L. brevis, però després s’han trobat també a L. lindneri, L. paracollinoides i el més conegut P. damnosus (Suzuki et al 2006).
Curiosament, HorA mostra una semblança del 54% amb OmrA, un transportador de membrana d’Oenococcus oeni, relacionat amb la tolerància d’aquest bacteri del vi a l’etanol i altres factors d’estrés (Bourdineaud et al 2004) (Vegeu alguna cosa més sobre O. oeni al meu post sobre els bacteris de la vinya i el vi). Per tant, és probable que HorA tingui també funcions d’exclusió d’altres compostos a banda dels del llúpol. S’ha vist que aquests gens de resistència horA i horC i les seves regions flanquejants estan molt ben conservades i tenen les seqüències quasi idèntiques a les diferents espècies que les tenen; per tant, és molt probable que unes les hagin adquirit de les altres mitjançant transferència gènica horitzontal, per plasmidis o transposons, com és usual en molts altres bacteris (Suzuki 2011).
Figura 9. Mecanismes de resistència als compostos del llúpol (Hop) a Lactobacillus brevis (Suzuki 2011).
Com veiem a la mateixa Figura 9, els protons entrats són bombejats a fora per una ATPasa, i el consum d’ATPs és compensat formant-ne gràcies al consum de substrats com citrat, malat, piruvat o arginina. Un altre mecanisme de resistència, passiu en aquest cas, és la modificació de la composició d’àcids grassos de membrana, amb la incorporació de més saturats, com el C16:0, disminuint la fluïdesa de membrana i dificultant l’entrada dels compostos del llúpol. Això també ens recorda els canvis de membrana a O. oeni relacionats amb la resistència a etanol (Margalef-Català et al 2016). La paret cel·lular també canvia la seva composició en presència dels alfa-iso-àcids del llúpol, augmentant-ne la quantitat dels lipoteicoic d’alt pes molecular, la qual cosa també faria de barrera. Veiem també (Figura 9) com els compostos del llúpol poden fer disminuir els nivells intracel·lulars de Mn2+, i aleshores s’observa una major síntesi de proteïnes dependents de Mn i una major captació de Mn2+ de l’exterior. Finalment, les cèl·lules de L. brevis quan són a la cervesa redueixen la seva mida (Figura 10), probablement per disminuir la superfície extracel·lular, i així minimitzar l’efecte dels compostos tòxics externs (Suzuki 2011).

Figura 10. Efectes de l’adaptació a la cervesa (esquerra) en la mida de les cèl·lules de Lactobacillus brevis en comparació a les crescudes en medi ric MRS (dreta). Les barres fan 5 µm (Suzuki 2011).
Tots aquests mecanismes s’han estudiat a soques de L. brevis perjudicials de la cervesa, però se suposa que la resistència que també tenen els bacteris beneficiosos de les làmbiques i altres ha de ser deguda als mateixos mecanismes, ja que són de les mateixes espècies bacterianes.
Com a conclusió de tot el que he comentat, veiem que els bacteris làctics tenen uns papers destacables com a beneficiosos en diversos aspectes de la cerveseria i malteria, malgrat el seu paper més conegut de perjudicials en l’elaboració de les cerveses més habituals.
Bibliografia
Birrapedia (vist 18 agost 2018) Cervezas de tipo Fruit Lambic elaboradas en España. https://birrapedia.com/cervezas/del-tipo-fruit-lambic-elaboradas-en-espana
Bokulich NA et al (2012) Brewhouse resident microbiota are responsible for multi-stage fermentation of American Coolship Ale. PLoS One, 7, e35507
Bourdineaud J et al (2004) A bacterial gene homologous to ABC transporters protect Oenococcus oenifrom ethanol and other stress factors in wine. Int J Food Microbiol 92, 1-14.
Cervesa en català (2012) Fitxes de degustació – Timmermans Gueuze Tradition http://cervesaencatala.blogspot.com.es/2012/06/fitxes-de-degustacio-timmermans-gueuze.html
Jackson, Michael (1999) Belgium’s great beers. Beer Hunter Online, july 30, 1999
Kumara HMCS & Verachtert H (1991) Identification of Lambic superattenuating micro-organisms by the use of selective antibiotics. J Inst Brew 97, 181-185
Loret S et al (2005) Levels of biogenic amines as a measure of the quality of the beer fermentation process: data from Belgian samples. Food Chem 89, 519-525
Lowe DP & Arendt EK (2004) The use and effects of lactic acid bacteria in malting and brewing with their relationships to antifungal activity, mycotoxins and gushing: a review. J Inst Brew 110, 163-180
Margalef-Català et al (2016) Protective role of glutathione addition against wine-related stress in Oenococcus oeni. Food Res Int 90, 8-15
Menz G et al (2009) Pathogens in beer, in Beer in Health and Disease Prevention, (Preedy, V. R. Ed.), 403–413, Academic Press, Amsterdam
Ray AL (2014) Coolships rising: the next frontier of sour beers in the U.S. First we feast 27 feb 2014
Sakamoto K & Konings WN (2003) Beer spoilage bacteria and hop resistance. Int J Food Microbiol 89, 105-124
Spitaels F et al (2014) The microbial diversity of traditional spontaneously fermented lambic beer. PLOS One 9, 4, e95384
Suzuki K et al (2006) A review of hop resistance in beer spoilage lactic acid bacteria. J Inst Brew 112, 173-191
Suzuki K (2011) 125th Anniversary Review: microbiological instability of beer caused by spoilage bacteria. J Inst Brew 117, 131-155
The Beer Wench (2008) My obsession with wild beers. Nov. 20, 2008 https://thecolumbuswench.wordpress.com/tag/lambic/
Verachtert H & Debourg A (1999) The production of gueuze and related refreshing acid beers. Cerevisia, 20, 37–41
Vriesekoop F et al (2012) 125th Anniversary review: Bacteria in brewing: the good, the bad and the ugly. J Inst Brew 118, 335-345
Bacillus com a probiòtics
Click here for the English version: Bacillus as probiotics
4 d’agost 2017
Els probiòtics
Els probiòtics són microorganismes vius que, en ingerir-los en quantitats adequades, poden tenir algun efecte positiu sobre la salut dels hostes (FAO/WHO 2006; World Gastroenterology Organisation 2011; Fontana et al. 2013). Els hostes poden ser els humans però també altres animals. Els bacteris làctics, sobretot del gènere Lactobacillus, i els bifidobacteris, ambdós considerats com a GRAS (Generally recognized as safe, generalment reconeguts com a segurs), són els més utilitzats com a probiòtics, però altres bacteris i alguns llevats també poden ser útils. A banda de poder ser administrats com a medicaments, els probiòtics es consumeixen normalment des de fa mil·lennis com una part dels aliments fermentats, com passa amb el iogurt i altres productes làctics (vegeu el meu article “Formatge europeu de fa 7400 anys ….” 26 desembre 2012). Com a medicaments, els probiòtics generalment són venuts sense recepta, de venda lliure a les farmàcies (OTC en anglès, over-the-counter).
Ja he comentat en altres articles d’aquest blog la rellevància dels probiòtics (“Un nou probiòtic activa la microbiota contra el càncer de fetge” 13 juliol 2016), així com de la microbiota que conviu amb el nostre cos (“Bacteris controlant el que mengem” 8 set 2014 ; “Bacteris de la llet materna” 26 gener 2013) i dels altres animals (“Microbiota de la pell humana … i del gos de casa” 17 novembre 2015; “El panda gegant i la seva microbiota…” 26 agost 2015).
A banda dels bacteris làctics i els bifidobacteris, altres microorganismes que també s’utilitzen en certa mesura com a probiòtics són el llevat Saccharomyces cerevisiae, algunes soques d’Escherichia coli, i alguns Bacillus, com ara veurem. També comencen a utilitzar-se alguns clostridials, en relació al que vaig comentar en un article anterior d’aquest mateix blog pel març 2015 (“Tenim clostridis bons al budell….”).
Els Bacillus
De fet, els Bacillus i els clostridials tenen en comú la capacitat de formar endòspores. I tots dos grups són grampositius, dins del fílum taxonòmic Firmicutes (Figura 1), que inclou també els bacteris làctics. Tanmateix, els bacil·lals (Bacillus i altres semblants, però també estafilococs i Listeria) són evolutivament més a prop dels lactobacil·lals (els bacteris làctics) que dels clostridials. La principal diferència fisiològica entre Clostridium i Bacillus és que els primers són anaerobis estrictes i Bacillus són aerobis o facultatius.

Figura 1. Esquema d’arbre filogenètic dels bacteris grampositius (Firmicutes i Actinobacteris). Elaboració pròpia.
Les endòspores bacterianes (Figura 2) són les estructures biològiques més resistents, ja que sobreviuen als ambients inhòspits extrems, com radiacions UV i gamma, dessecació, lisozim, altes temperatures (són la referència per als càlculs d’esterilització tèrmica), falta de nutrients i desinfectants químics. Es troben al terra i a l’aigua, on poden sobreviure durant períodes de temps molt llargs.

Figura 2. Endòspores (les parts blanques) de Bacillus subtilis en formació (Imatge de Simon Cutting).
Bacillus als aliments fermentats, sobretot asiàtics
Diversos Bacillus estan implicats clàssicament en els processos de fermentació d’aliments, sobretot per la seva capacitat de producció de proteases, amb la qual cosa durant les fermentacions contribueixen a l’enriquiment nutritiu amb els aminoàcids resultants de la proteòlisi enzimàtica.
Uns d’aquests aliments són els fideus de farina d’arròs fermentada, típics de Tailàndia i Birmània. S’ha vist que en aquesta fermentació intervé una varietat de microorganismes, amb bacteris làctics, llevats i altres fongs, però també bacteris aerobis entre els que hi ha B. subtilis. S’ha trobat que l’activitat proteolítica d’aquests digereix i elimina substrats proteics de l’arròs que són al·lèrgens, com l’azocaseïna, i per tant tenen una activitat beneficiosa per a la salut dels consumidors (Phromraksa et al. 2009).
Tanmateix, l’aliment fermentat amb Bacillus més conegut és la soja fermentada alcalina. Com sabeu, la soja (Glycine max) o faves de soja, són un dels vegetals nutritius més consumits històricament, sobretot als països asiàtics. Se n’obté “llet” de soja, farina de soja, oli de soja, concentrat de soja, iogurt de soja, tofu (llet de soja quallada), i productes fermentats com la salsa de soja, el tempeh, el miso i altres. La majoria d’aquests fermentats es fan amb el fong Rhizopus, afavorint el seu creixement per acidificació o inoculant-lo directament. En canvi, si no s’acidifica i les faves de soja es deixen fermentar només amb aigua, els microbis naturals predominants que ho fermenten són Bacillus, i d’aquesta manera s’obté, entre altres, el “chongkukjang” coreà, el “kinema” de la Índia, el “thua nao” del nord de Taïlàndia, el “douchi” xinès, el “chine pepoke” birmà, i el més conegut, el “natto” japonès (Figura 3). La fermentació espontània amb els Bacillus dona amoni com a subproducte, i per això és alcalina, la qual cosa dóna una olor no gaire bona a molts d’aquests productes, però el natto s’elabora amb un cultiu seleccionat de B. subtilis que hi dóna un olor més suau i agradable (Chukeatirote 2015).
Aquests aliments són bons del punt de vista nutritiu ja que contenen proteïnes, fibra, vitamines, i tot d’origen vegetal o microbià. A més, la publicitat del natto comercial emfatitza, a banda de què és elaborat artesanalment i es ven fresc (no congelat), les seves qualitats probiòtiques, dient que els B. subtilis (Figura 4) que conté promouen la salut gastrointestinal, immunològica, cardiovascular i dels ossos (www.nyrture.com). Diuen que el sabor i la textura del natto són exquisits. Es menja amb arròs o amb altres ingredients i salses, i també dins el maki sushi. Caldrà provar-lo !

Figura 3. El “natto”, faves de soja fermentades amb B. subtilis, esmorzar amb arròs, típic japonès (Pinterest.com)

Figura 4. Micrografia electrònica colorejada de Bacillus subtilis (Nyrture.com)
Bacillus com a probiòtics
Justament les endòspores són el principal avantatge dels Bacillus per ser utilitzats com a probiòtics, gràcies a la seva estabilitat tèrmica i per poder sobreviure les condicions gàstriques (Cutting 2011). Si bé Clostridium també té aquest avantatge, la seva condició d’anaerobi estricte en fa més complexa la seva manipulació, a banda del “mal nom” d’aquest gènere degut a algunes conegudes espècies tòxiques d’aquest gènere.
A diferència d’altres probiòtics com Lactobacillus o Bifidobacterium, les endòspores de Bacillus poden ser emmagatzemades indefinidament sense aigua. Els productes comercials s’administren en dosis d’unes 10^9 espores per gram o per ml.
Cada cop hi ha més productes comercials de probiòtics que contenen Bacillus, tant per a consum humà (Taula 1) com per a ús veterinari (Taula 2). A més a més, també hi ha uns 5 productes específics per a aqüicultura amb diversos Bacillus, i a més sovint les granges de gambes utilitzen els de consum humà (Cutting 2011).
Per a ús en l’aqüicultura s’han obtingut productes probiòtics de barreges de Bacillus (B. thuringiensis, B. megaterium, B. polymixa, B. licheniformis i B. subtilis) aïllant-los de l’intestí de la gamba Penaeus monodon infectada de vibriosis. S’han seleccionat en base a biodegradació de nutrients i a la capacitat inhibitòria del patogen Vibrio harveyi (Vaseeharan & Ramasamy 2003) Són preparats en liòfil o microencapsulades en alginat sòdic, i s’ha comprovat que milloren significativament el creixement i la supervivència de les gambes (Nimrat et al. 2012).
Com veiem per als productes de consum humà, quasi la meitat de les marques (10 de 25) són elaborades al Vietnam. En aquest país l’ús de Bacillus probiòtics està més desenvolupat que en qualsevol altre, però els motius no estan clars. Curiosament allà, com en altres països del sud est asiàtic, no hi ha el concepte de suplements dietètics i els probiòtics com Bacillus només són venuts com a medicaments aprovats pel Ministeri de Salut. Es prescriuen per a la infecció per rotavirus (diarrea infantil) o la estimulació immunològica enfront enverinaments, o són molt freqüentment utilitzats com a teràpia contra infeccions entèriques. Tanmateix, no està clar que s’hagin fet proves clíniques i són productes fàcils de comprar (Cutting 2011).
Taula 1. Productes comercials de probiòtics amb Bacillus, per a consum humà (modificat de Cutting 2011).
| Producte | País del fabricant | Espècies de Bacillus |
| Bactisubtil ® | França | B. cereus |
| Bibactyl ® | Vietnam | B. subtilis |
| Bidisubtilis ® | Vietnam | B. cereus |
| Bio-Acimin ® | Vietnam | B. cereus i 2 altres |
| Biobaby ® | Vietnam | B. subtilis i 2 altres |
| Bio-Kult ® | Regne Unit | B. subtilis i 13 altres |
| Biosporin ® | Ucraïna | B. subtilis + B. licheniformis |
| Biosubtyl ® | Vietnam | B. cereus |
| Biosubtyl DL ® | Vietnam | B. subtilis i 1 altre |
| Biosubtyl I i II ® | Vietnam | B. pumilus |
| Biovicerin ® | Brasil | B. cereus |
| Bispan ® | Corea Sud | B. polyfermenticus |
| Domuvar ® | Itàlia | B. clausii |
| Enterogermina ® | Itàlia | B. clausii |
| Flora-Balance ® | Estats Units | B. laterosporus * |
| Ildong Biovita ® | Vietnam | B. subtilis i 2 altres |
| Lactipan Plus ® | Itàlia | B. subtilis * |
| Lactospore ® | Estats Units | B. coagulans * |
| Medilac-Vita ® | Xina | B. subtilis |
| Nature’s First Food ® | Estats Units | 42 soques, incloent 4 B. |
| Neolactoflorene ® | Itàlia | B. coagulans * i 2 altres |
| Pastylbio ® | Vietnam | B. subtilis |
| Primal Defense ® | Estats Units | B. subtilis |
| Subtyl ® | Vietnam | B. cereus |
| Sustenex ® | Estats Units | B. coagulans |
* Alguns etiquetats com Lactobacillus o altres bacteris porten realment Bacillus
Taula 2. Productes comercials de probiòtics amb Bacillus, per a ús veterinari (modificat de Cutting 2011).
| Producte | Animal | País del fabricant | Espècies de Bacillus |
| AlCare ® | Porcs | Austràlia | B. licheniformis |
| BioGrow ® | Pollastres, vedells, porcs | Regne Unit | B. licheniformis i B. subtilis |
| BioPlus 2B ® | Porcs, pollastres, dindis | Dinamarca | B. licheniformis i B. subtilis |
| Esporafeed Plus ® | Porcs | Espanya | B. cereus |
| Lactopure ® | Pollastres, vedells, porcs | Índia | B. coagulans * |
| Neoferm BS 10 ® | Pollastres, vedells, porcs | França | B. clausii |
| Toyocerin ® | Vedells, pollastres, conills i porcs | Japó | B. cereus |
Les espècies de Bacillus que veiem en aquestes Taules són les que realment s’hi troben, un cop feta la identificació, ja que molts d’aquests productes estan mal etiquetats com a Bacillus subtilis o fins i tot com a Lactobacillus (Green et al. 1999; Hoa et al 2000). Aquests errors en l’etiquetatge poden ser preocupants per al consumidor, i sobretot per qüestions de seguretat, ja que alguns dels trobats són Bacillus cereus, que s’ha vist que pot ser causa d’infeccions gastrointestinals ja que força soques produeixen enterotoxines (Granum & Lund 1997; Hong et al. 2005)
Els possibles Bacillus probiòtics han estat aïllats de diversos orígens. Per exemple recentment se n’han aïllat alguns B. subtilis de l’esmentat chongkukjang coreà, que tenen bones característiques de resistència a les condicions del tracte gastrointestinal (GI) i activitat antimicrobiana contra Listeria, Staphylococcus, Escherichia i fins i tot contra B. cereus (Lee et al 2017).
Un d’aquests productes farmacèutics més coneguts és l’Enterogermina (Figura 5), amb espores de B. subtilis, que és recomanat per al tractament de desordres intestinals associats a alteracions de la microbiota (Mazza 1994).

Figura 5. Enterogermina amb espores de Bacillus subtilis (Cutting 2011)
Bacillus al tracte gastrointestinal: hi són ? hi poden sobreviure ?
S’ha discutit si les espores administrades poden germinar al tracte GI. Treballant amb ratolins, Casula & Cutting (2002) han utilitzat B. subtilis modificats, amb un gen quimèric ftsH-lacZ, que s’expressa només en cèl·lules vegetatives, amb el que es poden detectar per RT-PCR fins a només 100 bacteris. D’aquesta manera han vist que les espores germinen en nombres significatius al jejú i a l’ili. O sigui, que les espores podrien colonitzar l’intestí prim, encara que transitòriament.
De manera similar, Duc et al. (2004) han conclòs que les espores de B. subtilis poden germinar al budell perquè després del tractament oral dels ratolins, se n’excreten més espores a la femta que les ingerides, senyal que han pogut proliferar. També han detectat, mitjançant RT-PCR, mRNA dels bacils vegetatius després de l’administració de les espores, i a més a més, s’ha observat que el ratolí genera resposta amb IgG contra cèl·lules vegetatives del bacteri. O sigui, que les espores no serien passavolants transitoris, sinó que germinarien passant a cèl·lules vegetatives, les quals tindrien una interacció activa amb les cèl·lules hoste o la microbiota, augmentant-ne l’efecte probiòtic.
Amb tot això, potser caldria considerar a molts Bacillus no com a al·lòctons al tracte GI, sinó com a bacteris amb un cicle de vida bimodal de creixement i esporulació, tant al medi ambient com dins el tracte GI de molts animals (Hong et al. 2005).
En quant a la presència normal de Bacillus a l’intestí, quan s’estudien els diferents microorganismes habitants del digestiu humà per anàlisi metagenòmic del DNA de la microbiota, el gènere Bacillus no apareix (Xiao et al. 2015). Com veiem (Figura 6), els més habituals són Bacteroides i Clostridium, seguits de diversos enterobacteris i altres, inclosos els bifidobacteris.

Figura 6. Els 20 gèneres bacterians més abundants a l’intestí d’humans (dreta) i ratolins (esquerra) (Xiao et al. 2015).
Malgrat això, s’han aïllat diverses espècies de Bacillus al tracte GI de pollastres, tractant mostres fecals amb calor i etanol per seleccionar només les espores, seguit d’incubació aeròbica (Barbosa et al. 2005). I més en concret, la presència de B. subtilis a la microbiota d’humans s’ha confirmat mitjançant aïllament selectiu en biòpsies d’ili i també de mostres fecals (Hong et al. 2009). Aquestes soques de B. subtilis presentaven gran diversitat i tenien capacitat de formar biofilms, esporular anaeròbiament i secretar antimicrobians, amb la qual cosa es confirma l’adaptació d’aquests bacteris a l’intestí, i per tant poden ser considerats comensals intestinals, i no solament bacteris del sòl.
Seguretat dels Bacillus probiòtics
El consum oral de quantitats importants de microorganismes viables que no són molt usuals al tracte GI posa sobre la taula dubtes addicionals sobre la seguretat. Això encara més en l’ús d’espècies que no tenen una història d’utilització segura en aliments, com és el cas dels bacteris esporulats. Fins i tot els habitants normals de l’intestí poden actuar a vegades com a patògens oportunistes (Sanders et al. 2003).
Amb l’excepció de B. anthracis i B. cereus, les diverses espècies de Bacillus generalment no es consideren patogèniques. Per suposat, les espores de Bacillus són consumides de forma usual sense adonar-se’n amb els aliments i en alguns fermentats. Encara que els Bacillus són reconeguts com a GRAS per a la producció d’enzims, fins ara la FDA no ha garantit l’estatus de GRAS per a cap esporulat amb aplicació com a probiòtic, ni Bacillus ni Clostridium. Mentre que Lactobacillus i Bifidobacterium han estat subjecte de nombroses i rigoroses proves de no toxicitat crònica i aguda, i un munt d’experts han revisat dades i han conclòs que són segurs com a probiòtics, no hi han dades de toxicitat publicades sobre Bacillus en relació al seu ús com a probiòtics. En fer un repàs al Medline d’articles on surti el terme “probiotic” limitant-se a estudis clínics, de 123 referències no hi ha cap on surti Bacillus (Sanders et al. 2003).
En canvi, hi ha alguns estudis clínics on soques de Bacillus han estat detectades com a toxigèniques. Tot això explica que alguns productors de Bacillus probiòtics es refereixen a ells amb l’enganyós nom de Lactobacillus sporogenes, espècie inexistent, com es pot comprovar al NCBI (https://www.ncbi.nlm.nih.gov/taxonomy/?term=lactobacillus+sporogenes).
Finalment, cal recordar l’informe conjunt sobre probiòtics de la FAO (Organització de les Nacions Unides per a l’Alimentació i l’Agricultura) i la OMS (Organització Mundial de la Salut) (FAO/WHO 2006), que suggereix un conjunt de directrius per tal que un producte sigui utilitzat com a probiòtic, tant en forma única com en forma de nou suplement alimentari. Aquestes recomanacions són:
- Que el microorganisme estigui ben caracteritzat a nivell d’espècie, utilitzant mètodes fenotípics i genotípics (ex. 16S rRNA).
- Que la soca en qüestió estigui dipositada en alguna col·lecció de cultius reconeguda internacionalment.
- Avaluació de la soca in vitro per determinar-ne l’absència de factors de virulència: que no sigui citotòxica ni envaeixi cèl·lules epitelials, i que no produeixi enterotoxines o hemolisines o lecitinases.
- Determinació de la seva activitat antimicrobiana, i el perfil de resistència, incloent l’absència de gens de resistència i la incapacitat per transferir factors de resistència.
- Avaluació preclínica de la seva seguretat en models animals.
- Confirmació en animals demostrant-ne la seva eficàcia.
- Avaluació en humans (Fase I) de la seva seguretat.
- Avaluació en humans (Fase II) de la seva eficàcia (si fa l’efecte esperat) i eficiència (amb el mínim de recursos i el mínim temps).
- Etiquetatge correcte del producte, incloent gènere i espècie, dosi precisa i condicions de conservació.

Conclusions
La utilització de Bacillus com a probiòtics, sobretot en forma de suplements dietètics, està augmentant molt ràpidament. Cada cop més estudis científics demostren els seus beneficis, com estimulació immune, activitats antimicrobianes i competència exclusiva. El seu principal avantatge és que poden ser produïts fàcilment i que el producte final, les espores, és molt estable, amb la qual cosa poden ser incorporats fàcilment al menjar quotidià. A més, hi ha estudis que suggereixen que aquests bacteris poden multiplicar-se al tracte GI i poden ser considerats com a residents temporals (Cutting 2011).
D’altra banda, cal demanar un major rigor en la selecció i control dels Bacillus utilitzats, ja que alguns, si no han estat ben identificats, podrien ser causa de trastorns intestinals. En qualsevol cas, donat que el nombre de productes venuts com a probiòtics que contenen els esporulats Bacillus està augmentant molt, cal no donar per suposat que tots són segurs i cal avaluar cas per cas (Hong et al 2005).
Bibliografia
Barbosa TM, Serra CR, La Ragione RM, Woodward MJ, Henriques AO (2005) Screening for Bacillus isolates in the broiler gastrointestinal tract. Appl Environ Microbiol 71, 968-978.
Casula G, Cutting SM (2002) Bacillus probiotics: Spore germination in the gastrointestinal tract. Appl Environ Microbiol 68, 2344-2352.
Chukeatirote E (2015) Thua nao: Thai fermented soybean. J Ethnic Foods 2, 115-118.
Cutting SM (2011) Bacillus probiotics. Food Microbiol 28, 214-220.
Duc LH, Hong HA, Barbosa TM, Henriques AO, Cutting SM (2004) Characterization of Bacillus probiotics available for human use. Appl Environ Microbiol 70, 2161-2171.
FAO/WHO (2006) Probiotics in food. Health and nutritional properties and guidelines for evaluation. Fao Food and Nutrition Paper 85. Reports of Joint FAO/WHO expert consultations.
Fontana L, Bermudez-Brito M, Plaza-Diaz J, Muñoz-Quezada S, Gil A (2013) Sources, isolation, characterization and evaluation of probiotics. Brit J Nutrition 109, S35-S50.
Granum, P. E., T. Lund (1997) Bacillus cereus and its food poisoning toxins. FEMS Microbiol. Lett. 157:223–228.
Green, D. H., P. R. Wakeley, A. Page, A. Barnes, L. Baccigalupi, E. Ricca, S. M. Cutting (1999) Characterization of two Bacillus probiotics. Appl Environ Microbiol 65, 4288–4291.
Hoa, N. T., L. Baccigalupi, A. Huxham, A. Smertenko, P. H. Van, S. Ammendola, E. Ricca, A. S. Cutting (2000) Characterization of Bacillus species used for oral bacteriotherapy and bacterioprophylaxis of gastrointestinal disorders. Appl Environ Microbiol 66, 5241–5247.
Hong HA, Dic LH, Cutting SM (2005) The use of bacterial spore formers as probiotics. FEMS Microbiol Rev 29, 813-835.
Hong HA, Khaneja R, Tam NMK, Cazzato A, Tan S, Urdaci M, Brisson A, Gasbarrini A, Barnes I, Cutting SM (2009) Bacillus subtilis isolated from the human gastrointestinal tract. Res Microbiol 160, 134-143.
Lee S, Lee J, Jin YI, Jeong JC, Hyuk YH, Lee Y, Jeong Y, Kim M (2017) Probiotic characteristics of Bacillus strains isolated from Korean traditional soy sauce. LWT – Food Sci Technol 79, 518-524.
Mazza P (1994) The use of Bacillus subtilis as an antidiarrhoeal microorganism. Boll Chim. Farm. 133, 3-18.
Nimrat S, Suksawat S, Boonthai T, Vuthiphandchai V (2012) Potential Bacillus probiotics enhance bacterial numbers, water quality and growth during early development of white shrimp (Litopenaeus vannamei). Veterinary Microbiol 159, 443-450.
Phromraksa P, Nagano H, Kanamaru Y, Izumi H, Yamada C, Khamboonruang C (2009) Characterization of Bacillus subtilis isolated from asoian fermented foods. Food Sci Technol Res 15, 659-666.
Sanders ME, Morelli L, Tompkins TA (2003) Sporeformers as human probiotics: Bacillus, Sporolactobacillus, and Brevibacillus. Compr Rev Food Sci Food Safety 2, 101-110
Vaseeharan, B., P. Ramasamy (2003) Control of pathogenic Vibrio spp. by Bacillus subtilis BT23, a possible probiotic treatment for black tiger shrimp Penaeus monodon. Lett Appl Microbiol 36, 83–87
World Gastroenterology Organisation Global Guidelines (2011) Probiotics and Prebiotics.
Xiao et al. (2015) A catalog of the mouse gut metagenome. Nature Biotechnol 33, 1103-1108.

Els bacteris de l’intestí ens controlen el què mengem
Click here for the english version: Bacteria in the gut are controlling what we eat
8 setembre 2014
Sembla que és així: els microbis del nostre tracte gastrointestinal (TGI) influeixen en la nostra tria de menjar. No és estrany: els microbis, bacteris bàsicament, són presents al TGI en quantitats importants, més de 10 cèl.lules bacterianes per cadascuna de les nostres, un total de 1014 (el cós humà té unes 1013 cèl.lules). Això equival a uns 1-1.5 kg de pes. I aquest bacteris conviuen amb nosaltres des de sempre, ja que tots els mamífers en tenen, amb la qual cosa han anat evolucionant amb els nostres precursors i per tant estan molt ben adaptats al nostre ambient intern. Com que per a ells els nostres cossos són el seu hàbitat, doncs millor si poden controlar el que els arriba a l’intestí. I cóm ho poden fer ? Doncs donant ordres al cervell per menjar tal cosa o tal altra que els vagin bé als microbis.
Figura 1. “Centre de comandament del tracte gastro-intestinal” (muntatge propi, Albert Bordons)
Bé, doncs anat seriosament, hi ha alguns treballs previs en aquest sentit, d’una relació entre les preferències per una dieta determinada i la composició microbiana del TGI (Norris et al 2013). De fet, és una interacció bidireccional, una més dels molts aspectes de mutualisme simbiòtic entre nosaltres i la microbiota que ens habita (Dethlefsen et al 2007).
Hi ha moltes proves que la dieta influeix en la microbiota. Un dels exemples més vistosos és que s’ha vist que els nens africans alimentats quasi exclusivament en sorgo tenen més microbis cel.lulolítics que altres nens (De Filippo et al 2010).
El cervell també pot influir indirectament en la microbiota entèrica per canvis en la motilitat, secreció i permeabilitat gastrointestinals, o directament alliberant molècules al lumen del digestiu des de cèl.lules (del sistema immune o neurones) subepitelials (Rhee et al 2009).
El TGI és un ecosistema complex on diferent espècies de bacteris i altres microorganismes han de competir i col.laborar entre ells i amb les cèl.lules de l’hoste. El menjar ingerit per l’hoste (humà o altres mamífers) és un factor important en la selecció contínua d’aquests microbis i la naturalesa d’aquest menjar està sovint determinada per les preferències de l’hoste. Els bacteris que puguin manipular aquestes preferències tindran avantatges sobre els que no ho facin (Norris et al 2013).
Recentment Alcock et al (2014) han recollit en una revisió les evidències en aquest sentit. Els microbis poden manipular la conducta alimentària de l’hoste en benefici propi a través de diverses estratègies possibles. Veiem-ne a continuació alguns exemples relacionats amb l’esquema de la Figura 2.
Figura 2. Com si els microbis fossin titellaires i els humans fóssim les titelles, els microbis poden controlar el que volem menjar mitjançant una sèrie de mecanismes senyalats. Adaptat de Alcock et al 2014.
Les persones que tenen “desitjos” de xocolata tenen diferents metabòlits microbians a l’orina que les persones indiferents per a la xocolata, malgrat tenir la mateixa dieta.
La disfòria, o sigui, el malestar en l’humà fins que mengem aliments que milloren el “benestar” microbià, pot ser deguda a l’expressió de gens bacterians de virulència i la percepció de dolor per l’hoste. Això és perquè la producció de toxines sovint és desencadenada per una baixa concentració de nutrients limitants del creixement. La detecció de sucres i altres nutrients regula la virulència i el creixement de diversos microbis. Aquests lesionen directament l’epiteli intestinal quan alguns nutrients són absents. D’acord amb aquesta hipòtesi, s’ha demostrat que proteïnes de virulència bacteriana activen els receptors de dolor. S’ha vist que el dejuni en ratolins augmenta la percepció del dolor per un mecanisme del nervi vagal.
Els microbis també poden alterar les preferències alimentàries dels hostes canviant l’expressió dels receptors del gust a l’hoste. En efecte, per exemple s’ha vist que ratolins lliures de microbis prefereixen més els dolços i tenen un major nombre de receptors del dolç a la llengua i a l’intestí que els ratolins amb una microbiota normal.
La conducta alimentària de l’hoste també pot ser manipulada pels microbis mitjançant el sistema nerviós, pel nervi vague, que conecta les 100 milions de neurones del sistema nerviós entèric des de l’intestí a la base del cervell via medul.la. Els nervis entèrics tenen receptors que reaccionen amb la presència de determinats bacteris i dels metabòlits bacterians, com els àcids grassos de cadena curta. El nervi vague regula la conducta alimentària i el pes corporal. S’ha vist que l’activitat del nervi vague de rates estimulades amb norepinefrina fa que malgrat estar saciades segueixin menjant. Això suggereix que els microbis del TGI produeixen neurotransmissors que poden contribuir a la sobrealimentació.
Els neurotransmissors produïts pels microbis són anàlegs de les hormones dels mamífers relacionades amb l’estat d’ànim i el comportament. Més del 50% de la dopamina i la majoria de serotonina del cos tenen un origen intestinal. Molts habitants transitoris i persistents de l’intestí, incloent E. coli, diversos Bacillus, Proteus i Staphylococcus secreten dopamina. A la Taula 1 veiem un resum dels diversos neurotransmissors produïts per microbis del TGI. Al mateix temps, s’ha vist que enzims de l’hoste com l’amino-oxidasa poden degradar neurotransmissors produïts pels microorganismes, la qual cosa demostra les interaccions evolutives entre microbis i hostes.
Taula 1. Diversitat de neurotransmissors aïllats de diverses espècies microbianes (Roschchina 2010)
| Neurotransmissor | Gènere |
| GABA (àcid gamma-amino-butíric) | Lactobacillus, Bifidobacterium |
| Norepinefrina | Escherichia, Bacillus, Saccharomyces |
| Serotonina | Candida, Streptococcus, Escherichia, Enterococcus |
| Dopamina | Bacillus, Serratia |
| Acetilcolina | Lactobacillus |
Alguns bacteris indueixen a què els seus hostes els proveeixin els seus nutrients preferits. Per exemple, Bacteroides thetaiotaomicron es troba al mucus intestinal, on s’alimenta dels oligosacàrids secretats per les cèl.lules caliciformes de l’intestí, i aquest bacteri indueix el seu hoste mamífer a augmentar la secreció d’aquests oligosacàrids. Al contrari, Faecalibacterium prausnitzii, un no degradador de mucus, que es troba associat amb B. thetaiotaomicron, inhibeix la producció de mucus. Per tant, ens trobem en un ecosistema amb múltiples agents que interaccionen entre sí i amb l’hoste.
Com que la microbiota és fàcilment manipulable pels prebiòtics, probiòtics, antibiòtics, trasplantaments fecals, i canvis en la dieta, el control i l’alteració de la nostra microbiota ofereix un mètode viable als problemes altrament insolubles de l’obesitat i la mala alimentació.
Bibliografia
Alcock J, Maley CC, Aktipis CA (2014) Is eating behavior manipulated by the gastrointestinal microbiota? Evolutionary pressures and potential mechanisms. BioEssays 36, DOI: 10.1002/bies.201400071
De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, et al (2010) Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 107:14691–6
Dethlefsen L, McFall-Ngai M, Relman DA (2007) An ecological and evolutionary perspective on human-microbe mutualism and disease. Nature 449:811-818
Lyte M (2011) Probiotics function mechanistically as delivery for neuroactive compounds: Microbial endocrinology in teh design and use of probiotics. BioEssays 33:574-581
Norris V, Molina F, Gewirtz AT (2013) Hypothesis: bacteria control host appetites. J Bacteriol 195:411–416
Rhee SH, Pothoulakis C, Mayer EA (2009) Principles and clinical implications of the brain–gut–enteric microbiota axis. Nature Reviews Gastroenterology and Hepatology 6:306-314
Roschchina VV (2010) Evolutionary considerations of neurotransmitters in microbial, plant, and animal cells. In Lyte M, Freestone PPE, eds; Microbial Endocrinology: Interkingdom Signaling in Infectious Disease and Health. New York: Springer. pp. 17–52