Category Archives: probiòtics
Aliments fermentats: consens recent sobre aquest concepte
5 març 2021
Click here for the English version: Fermented foods: consensus statement and reviewing them
El terme “aliments fermentats” ha estat molt utilitzat però fins ara no ha tingut una definició clara, hi ha incoherències relacionades amb l’ús del terme “fermentat” i a vegades s’utilitza incloent productes més o menys relacionats, com els probiòtics. Tot i que aquests aliments s’han consumit durant milers d’anys, darrerament reben una atenció creixent entre biòlegs, nutricionistes, altres científics i consumidors.
Per tal de desenvolupar-ne una definició i descriure el paper dels aliments fermentats en la dieta humana, l’Associació Científica Internacional de Probiòtics i Prebiòtics (ISAPP) va convocar el setembre de 2019 a un grup d’experts per fer-ho de forma consensuada. La ISAPP és una organització sense ànim de lucre, dirigida per científics i acadèmics, i encara que és finançada per empreses, les seves activitats no estan estipulades per la indústria. La seva missió és proporcionar informació objectiva i científica sobre probiòtics, prebiòtics i altres temes relacionats amb la nutrició i la salut.

Figura 1. Portal d’internet de l’Associació Científica Internacional de Probiòtics i Prebiòtics (ISAPP)
Aquests experts del ISAPP han estat un total de 13, procedents dels USA, Irlanda, Canadà, Bèlgica i Corea S., la majoria de centres universitaris i alguns d’empreses, i les seves conclusions han estat publicades recentment (Marco et al 2021).
Una de les principals conclusions del consens al que han arribat és la mateixa definició: aliments i begudes fermentats són els elaborats mitjançant el creixement microbià desitjat, el qual comporta conversions enzimàtiques dels components dels aliments. En aquest treball, a banda de repassar quins són, també defineixen la distinció entre aliments fermentats i probiòtics, tracten el coneixement actual sobre seguretat, riscos i beneficis d’aquests aliments, i finalment en revisen la regulació i la possibilitat d’incloure’ls a les directrius dietètiques dels diferents països.
Què són els aliments fermentats ?
Els humans van aprendre fa alguns milers d’anys a consumir i elaborar aliments fermentats, probablement en paral·lel al desenvolupament de l’agricultura i la ramaderia. Vegeu per exemple el meu article sobre formatges i llets fermentades fets fa 7000 anys.
El consum d’aliments fermentats es va estendre i promoure des dels inicis a totes les civilitzacions sobretot perquè és una de les maneres més efectives de conservar aliments, degut a la formació de compostos que inhibeixen altres microbis perjudicials i/o patògens. Entre aquests compostos produïts pels microorganismes que fan la fermentació destaquen els àcids orgànics (com el làctic o l’acètic), l’etanol o les bacteriocines. Només cal recordar per un costat tots els productes lactis derivats de la llet que es conserven més temps que la llet gràcies a l’àcid làctic produït pels bacteris dels formatges, iogurts, etc. I per un altre costat, el consum de cerveses o vins com una bona alternativa més higiènica en llocs i èpoques on no es disposava d’aigua corrent no contaminada. La major perdurabilitat dels aliments fermentats encara té molta importància avui dia en regions pobres del món on no hi ha prou seguretat alimentària o on no hi ha gaire accés a l’electricitat, la refrigeració o l’aigua neta.
Altres mètodes de conservar aliments són la disminució de l’activitat aquosa (aw) mitjançant l’addició de sal o sucre o l’assecat, l’addició de compostos inhibidors (per ex. espècies o el fumat), fer el buit, i els tractaments tèrmics (fred o calor), entre altres.
L’altre motiu del consum d’aliments fermentats és l’aparició de noves qualitats organolèptiques, de gustos, olors o textures agradables i diferents, degut a les transformacions bioquímiques dels microorganismes en la composició de l’aliment.
Els aliments fermentats són una part important de la dieta humana, fins i tot en regions desenvolupades on la seguretat alimentària i la conservació dels aliments estan ben controlades. S’ha estimat que actualment es produeixen i consumeixen globalment més de 5000 varietats d’aliments (i begudes) fermentats (Tamang et al 2016).
Així doncs, en l’esmentada definició de consens de l’ISAPP queda ben clar que els aliments fermentats són aquells elaborats de forma volguda pels humans on cal l’activitat dels microorganismes i on aquests duen a terme una sèrie de reaccions enzimàtiques dels components de l’aliment.
Encara que els enzims endògens o exògens, procedents de plantes, animals o altres fonts, també poden estar presents en aquests aliments, aquesta activitat no és suficient per ser considerat com aliment fermentat, ja que cal l’activitat microbiana.
D’altra banda, la principal diferència amb els aliments deteriorats per microorganismes és que aquests aliments ho són de manera no volguda i els fermentats ho són deliberadament i controladament per generar-ne qualitats desitjables.
També cal puntualitzar que als aliments fermentats l’acció dels microorganismes no sempre és mitjançant el metabolisme de fermentació. Efectivament, des del punt de vista bioquímic, “fermentació” és un tipus de metabolisme on la font d’energia i tant el donador com l’acceptor d’electrons són compostos orgànics (sobretot carbohidrats), on els ATP es sintetitzen per fosforilació de substrat (per exemple a la glucòlisi) i no hi ha formació d’ATP per fosforilació oxidativa amb cadenes de transport d’electrons lligada a membranes, com seria el cas de la respiració (Figura 2). Molts aliments fermentats clàssics ho són per metabolisme fermentatiu com la fermentació làctica o l’alcohòlica, però també es consideren aliments fermentats alguns on els microorganismes estan fent respiració aeròbica, com els bacteris acètics del vinagre o les floridures d’alguns formatges. Per tant el terme “aliments fermentats” té una visió més ampla, independent del metabolisme, on només cal la intervenció activa i volguda de microorganismes.

Figura 2. Reaccions principals dels mecanismes bàsics de síntesi d’ATP: Fosforilació oxidativa per cadenes transportadores d’electrons (dalt) i Fosforilació a nivell de substrat (baix).
Quins són els aliments fermentats i els microorganismes implicats ?
En trobem una bona relació a nivell mundial al treball de Tamang et al (2016), amb els microorganismes que hi intervenen, resumits a la Taula 1. Naturalment aquest article no és una relació exhaustiva, ja que per exemple hi trobem a faltar la sobrassada balear, si bé apareix la “soppressata” siciliana, probablement relacionada en origen. Veiem alguns dels aliments fermentats més coneguts a la Figura 3.
Taula 1. Tipus d’aliments fermentats i els microorganismes implicats (resumit de Tamang et al (2016)
| Tipus | Productes | Països | Microorganismes |
| Llets fermentades i derivats | Iogurts, formatges, sèrum de mantega (buttermilk), quefir, kumis, leben, etc. Són de vaca i també de molts altres mamífers, com ovella, cabra, euga, camella, iac i búfala | Tot el món | Bacteris làctics Alguns bifidobacteris Alguns llevats Floridures (Penicillium) |
| Productes vegetals (fruits, talls, bulbs, fulles, arrels, llegums) fermentats | Olives, col àcida (sauerkraut), kimchi, molt diversos confitats de raves, albergínies, cebetes, pastanagues, fermentats de la mandioca, productes de la soja (salsa de soja, miso, natto, tempeh). Vins (veure a baix) | Tot el món | Bacteris làctics Bacillus i altres firmicutes Llevats Algunes floridures (Rhizopus) |
| Altres fermentats derivats de vegetals | Vinagre, té fermentat com la kombutxa, i cacau fermentat per fer xocolata | Tot el món | Bacteris acètics Llevats |
| Carns fermentades | Embotits com xoriço, peperoni, salsitxes, sobrassada | Tot el món, sobretot Europa | Bacteris làctics Altres firmicutes Alguns llevats |
| Peix i salses de peix fermentat | Molt diversos, ex. nuroc mam, nam pla Garum | Àsia orientalAntiga Roma | Bacteris làctics Altres firmicutes Altres bacteris |
| Begudes alcohòliques de cereals produïdes amb cultius amilolítics fúngics | Sake | Japó | Aspergillus oryzae Llevats |
| Begudes alcohòliques de cereals produïdes amb saliva humana | Txitxa (chicha) | Sudamèrica | Saliva Llevats Bacteris làctics i altres |
| Begudes alcohòliques de cereals (ordi, blat, etc) amb maltatge | Cerveses | Tot el món | Llevats Alguns bacteris làctics |
| Begudes alcohòliques de parts de plantes | Pulque de l’agave | Mèxic | Bacteris làctics Zymomonas Llevats |
| Begudes alcohòliques de fruites | Vins de vinya | Totes les regions de clima temperat | Llevats Oenococcus (ferm. malolàctica) |
| Begudes alcohòliques de la mel | hidromel tej | Sobretot món antic Etiopia | Llevats Bacteris làctics |
Com veiem a la Taula 1, els principals microorganismes de molts aliments fermentats des de les llets a carns i vegetals i altres, són els bacteris làctics. Són bacteris grampositius del fílum Firmicutes (amb baix G+C al DNA), no formadors d’espores, anaerobis aerotolerants, i considerats com a segurs. Altres bacteris responsables d’alguns aliments fermentats són els Bacillus (Firmicutes esporulats), altres Firmicutes com Staphylococcus, bacteris del fílum Actinobacteris (grampositius amb alt G+C al DNA) com Bifidobacterium, Propionibacterium i Brevibacterium. Dins els pocs bacteris gramnegatius que hi trobem, veiem que destaquen els acètics (del fílum Alfaproteobacteris) i també cal esmentar a Zymomonas, del mateix fílum. Podeu veure la ubicació filogenètica de tots aquests bacteris dins el meu post “Bacteris: 21 fílums principals, amb 147 gèneres importants“.
A la mateixa Taula 1 veiem que a banda dels bacteris, sobretot els làctics, els altres microorganismes més importants són els llevats, sobretot Saccharomyces, fongs ascomicets unicel·lulars. Altres fongs agents actius en aliments fermentats són sobretot alguns dels filamentosos, com els també ascomicets Penicillium i Aspergillus, i el zigomicet Rhizopus.

Figura 3. Diversos aliments fermentats: sobrassada, formatges, formatge blau, iogurt, olives, salsa de soja, cervesa i vi.
Microorganismes vius o morts als aliments fermentats ?
Els microorganismes que han intervingut activament en l’elaboració dels aliments fermentats poden estar presents i viables, o sigui vius, en alguns d’aquests i en canvi en altres són absents perquè se’ls ha separat de l’aliment o aquest ha tingut un tractament, normalment tèrmic, que els ha eliminat (Marco et al 2021).
Entre els aliments fermentats que contenen microorganismes vius podem esmentar el iogurt, quefir i altres llets fermentades, la majoria de formatges, miso, natto i tempeh, molts dels productes vegetals fermentats que no se’ls ha tractat tèrmicament com les olives, molts dels embotits, la kombutxa, i algunes cerveses.
Els aliments fermentats on s’han eliminat o apartat els microorganismes són per ex. el pa, els productes vegetals fermentats tractats tèrmicament, la salsa de soja, el vinagre, els vins, la majoria de cerveses, i les faves de cafè i de cacau un cop torrefactes.
En molts aliments fermentats sense inocular, o sigui amb la microbiota espontània pròpia, hi ha més d’un microorganisme responsable dels canvis que es duen a terme des de l’aliment original al fermentat. Sovint hi ha una successió de tipus de microorganismes, en funció de la composició de l’aliment i de les condicions ambientals a les que és sotmès: sal, temperatura, sequedat, etc. Per exemple, a la fermentació de les olives de taula primer predominen llevats i altres bacteris, i finalment s’acaben imposant els bacteris làctics.
Diferències respecte als probiòtics
Encara que a vegades els aliments fermentats són etiquetats o nomenats com “probiòtics” o que “contenen probiòtics”, cal deixar clar que no és el mateix i ni molt menys és així en la majoria dels casos. El terme probiòtic només és correcte utilitzar-lo quan s’ha demostrat algun efecte beneficiós per a la salut del consumidor del producte, i que aquest efecte és degut a un microorganisme viu present i ben caracteritzat. Aquest benefici sobre la salut és més enllà dels beneficis nutritius de la matriu de l’aliment que el conté. Per això, els termes “aliment fermentat” i “probiòtic” no poder ser utilitzats un per l’altre.
En el cas d’aliments fermentats que poden contenir algun microorganisme probiòtic, amb efectes demostrats sobre la salut, només hauria de ser etiquetat amb “conté probiòtics” en el cas que el microorganisme probiòtic estigués ben caracteritzat a nivell de soca i que estigués en quantitats significatives al llarg de la vida útil de l’aliment.
Els aliments fermentats i la seguretat alimentària
Els aliments fermentats augmenten la seguretat de l’aliment per al consumidor, en el sentit que hi és més difícil el creixement d’organismes perjudicials o patògens que respecte als aliments originals abans de fermentar. En efecte, sovint contenen quantitats notables d’àcids orgànics, com àcid làctic produït pels bacteris làctics o l’acètic fet pels bacteris homònims. Molts d’aquests productes al mateix temps tenen baixa activitat d’aigua, i contenen sal i altres antimicrobians, amb la qual cosa són coneguts com a segurs des de fa molt temps (Adams & Mitchell 2002). De manera semblant, les begudes que continguin >4% etanol o pH < 4.5 també són considerades microbiològicament segures.
A més, molts bacteris làctics, siguin autòctons o inoculats, produeixen bacteriocines que inhibeixen altres bacteris indesitjables, com Listeria o Clostridium.
Alguns aliments fermentats també incrementen la seguretat en eliminar compostos tòxics o antinutritius dels aliments crus, com és el cas de moltes fermentacions de cereals, llegums i tubercles. Per exemple, la mandioca conté glicòsids cianogènics que són eliminats a la fermentació per Lactobacillus plantarum (Lei et al 1999). També, a la fermentació de la massa mare (sourdough) alguns bacteris làctics faciliten la degradació mitjançant l’enzim fitasa (una fosfatasa) de l’àcid fític present als cereals, que és un quelant de cations divalents (Ca, Mg, Fe, Zn) i per tant disminueix la seva adsorció (López et al 2001).
A més, es pot afirmar que, amb molt poques excepcions, els microorganismes protagonistes dels aliments fermentats, bàsicament bacteris làctics, llevats i fongs filamentosos, no són patògens ni produeixen compostos tòxics o perjudicials. De fet, molts d’ells, com els mateixos bacteris làctics, però també força altres (com alguns Bacillus, Figura 4) són considerats GRAS per la FDA dels USA (generalment reconeguts com a segurs, en anglès) o QPS per la EFSA europea (presumpció qualificada de seguretat, en anglès).

Figura 4. Un dels últims ingredients declarats GRAS per la FDA dels USA és justament un Bacillus subtilis que també pot ser utilitzat en aliments fermentats. Tret de US FDA Gras Notices.
Tanmateix, cal sempre tenir molta cura, com en qualsevol tipus d’aliment, cal assegurar-se que els ingredients són frescos i segurs, evitar-ne qualsevol alteració, i tenir uns bons controls al llarg del procés d’elaboració i en el producte acabat, comprovant que no hi hagi cap contaminació dels habituals patògens alimentaris.
Alguns aliments fermentats contenen compostos que poden comportar riscos de seguretat alimentària si son consumits en excés. Aquest és el cas de les begudes alcohòliques, que cal prendre amb molta moderació pels efectes de l’etanol, i cal evitar el seu consum en persones de risc. Per un motiu diferent i no relacionat amb els microorganismes, també cal no consumir en excés els aliments fermentats que contenen sal, com la salsa de soja o el kimchi.
Uns dels pocs compostos produïts pels bacteris làctics que cal controlar són les amines biògenes, que es poden trobar en petites quantitats en aliments fermentats com formatges, embotits, alguns vegetals i el vi, i que poden produir diversos problemes de salut i sobretot migranyes. Cal minimitzar-ne la seva producció controlant els possibles productors i inoculant soques no productores.
Les micotoxines com aflatoxines, ocratoxines i moltes altres, són la principal preocupació dels aliments fermentats amb fongs filamentosos com Aspergillus i Penicillium dels fermentats de soja, formatges i altres (Sivamaruthi et al 2019). Tanmateix, en la majoria d’aquests productes s’utilitzen soques seleccionades, bé per domesticació al llarg de segles o bé més recentment per selecció artificial, que no produeixen toxines.
Beneficis del consum d’aliments fermentats sobre la salut nutritiva humana
Més enllà dels motius de preservació d’aliments i les qualitats organolèptiques, hi ha certes evidències epidemiològiques que suggereixen que les dietes riques en aliments fermentats poden reduir el risc de malalties i augmentar la longevitat, la salut i qualitat de vida. Però aquestes dietes, com pot ser la dieta mediterrània, inclouen altres aliments a banda dels fermentats, i per tant no és segur que els efectes positius siguin deguts als aliments fermentats. A més, amb l’excepció del iogurt i altres llets fermentades, s’han fet pocs estudis clínics ben dissenyats i controlats sobre els possibles beneficis dels aliments fermentats sobre la salut en quant a malalties concretes (Marco et al 2021).
Tanmateix, els efectes indirectes sobre la salut dels aliments fermentats són ben patents quan es consideren els aspectes nutritius. L’activitat microbiana dona lloc a l’enriquiment i/o eliminació de diversos compostos que afecten i milloren la composició nutritiva del producte final.
En primer lloc, els microorganismes redueixen el contingut de sucres altament calòrics, monosacàrids i disacàrids, presents a les llets, carns i vegetals. Això permet reduir l’índex glucèmic i disminuir la intolerància de l’aliment, com la lactosa dels lactis, els fructans del blat, o la rafinosa i estaquiosa dels llegums. Amb la fermentació s’hidrolitzen polisacàrids, proteïnes i greixos, la qual cosa facilita la digestió, i com s’ha comentat, s’eliminen diversos compostos tòxics o antinutritius com l’àcid fític.
En el cas dels aliments que contenen polifenols, s’ha comprovat que els lactobacils augmenten la biodisponibilitat de flavonoides, tanins i altres compostos bioactius. És ben coneguda la biosíntesi de vitamines, derivats d’aminoàcids, àcids orgànics com l’esmentat àcid làctic, pèptids i cofactors per part dels microbis que fermenten els aliments (Melini et al 2019).
S’ha vist que molts dels microorganismes vius dels aliments fermentats poden sobreviure el trànsit gàstric i arribar al còlon, ja que per exemple molts bacteris làctics són tolerants al pH àcid i les sals biliars i s’ha comprovat que poden arribar a mantenir-se transitòriament al còlon (Elli et al 2006). Encara que és improbable que aquests microorganismes sobrevisquin gaire temps, s’ha vist que sí que poden ser metabòlicament actius al tracte gastrointestinal, i que aquesta colonització a curt termini seria suficient per produir compostos bioactius, inhibir patògens i influir positivament en el sistema immunitari. Aquests efectes són incrementats si hi ha un consum diari i repetit de l’aliment fermentat.
També s’ha vist que els aliments fermentats, i els microorganismes que contenen, influeixen en la composició de la microbiota intestinal pròpia (Taylor et al 2020). Vegeu també González et al 2019 i Le Roy et al 2020. Un altre factor positiu addicional en el cas d’aliments fermentats vegetals és que força components d’aquests són prebiòtics i per tant afavoreixen la microbiota intestinal.
A més, cal tenir en compte la importància del que mengem, i en aquest cas dels aliments fermentats, en relació al sistema immune, ja que en els humans i altres mamífers el 70% d’aquest sistema es troba al tracte gastrointestinal i els aliments són la principal font de contacte entre els antígens externs i el nostre cos. Això és particularment important en els nadons i la colonització microbiana inicial del digestiu. La ingesta d’aliments fermentats durant els primers anys de la infància s’ha associat amb un risc reduït d’atòpia (predisposició genètica a les al·lèrgies) infantil (Alm et al 1999). Per a qualsevol edat, sembla que els microorganismes dels aliments fermentats i els seus components, com per ex. glucopèptid, proteïnes de superfície, exopolisacàrids, lipoteïcoic, o el D-fenil-làctic dels bacteris làctics (Peters et al 2019), són beneficiosos per al sistema immune, sobretot més demostrat en les llets fermentades (Bourrie et al 2016; Foligne et al 2016).
A la Figura 5 veiem un esquema dels mecanismes bàsics dels possibles beneficis dels aliments fermentats.

Figura 5. Mecanismes bàsics dels beneficis dels aliments fermentats per a la salut, sobretot del punt de vista nutritiu, amb les transformacions dels components dels aliments en substàcies bioactives. SCFA són els àcids grassos de cadena curta. Tret de Marco et al 2021.
Finalment, per acabar només comentar que malgrat que els aliments fermentats són consumits arreu del món i que compten aproximadament per 1/3 de la dieta humana, normalment són absents com a aliments recomanats en les guies de dietes (Marco et al 2021). També és una llàstima que la majoria d’informació que surt als mitjans o a les revistes de divulgació o a les xarxes socials sobre aquest tipus d’aliment és exagerat o erroni, sovint fent-los sinònims dels probiòtics.
Bibliografia
Adams M, Mitchell R (2002) Fermentation and pathogen control: a risk assessment approach. Int. J. Food Microbiol. 79, 75–83
Alm J S, Swartz J, Lilja G, Scheynius A, Pershagen, G (1999) Atopy in children of families with an anthroposophic lifestyle. Lancet 353, 1485–1488
Bourrie B C, Willing B P, Cotter P D (2016) The microbiota and health promoting characteristics of the fermented beverage kefir. Front Microbiol 7, 647
Elli M et al (2006) Survival of yogurt bacteria in the human gut. Appl Environ Microbiol 72, 5113–5117
Foligne B et al (2016) Immunomodulation properties of multi-species fermented milks. Food Microbiol 53, 60–69
González S et al (2019) Fermented dairy foods: impact on intestinal microbiota and health-linked biomarkers. Front Microbiol 10, 1046.
Iraporda C. et al (2015) Lactate and short chain fatty acids produced by microbial fermentation downregulate proinflammatory responses in intestinal epithelial cells and myeloid cells. Immunobiology 220, 1161–1169
ISAPP, The International Scientific Association for Probiotics and Prebiotics: https://isappscience.org
Lei V, Amoa-Awua WK, Brimer L (1999) Degradation of cyanogenic glycosides by Lactobacillus plantarum strains from spontaneous cassava fermentation and other microorganisms. Int. J. Food Microbiol. 53, 169–184
Le Roy C I et al (2020) Red wine consumption associated with increased gut microbiota α-diversity in 3 independent cohorts. Gastroenterology 158, 270–272
López HW et al (2001) Prolonged fermentation of whole wheat sourdough reduces phytate level and increases soluble magnesium. J. Agric. Food Chem. 49, 2657–2662
Marco ML, Sanders ME, Gänzle M et al (2021) The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods. Nature Rev Gastroenterol Hepatol. https://www.nature.com/articles/s41575-020-00390-5
Melini F, Melini V, Luziatelli F, Ficca AG, Ruzzi M (2019) Health-promoting components in fermented foods: an up-to-date systematic review. Nutrients 11, 1189
Peters A et al. (2019) Metabolites of lactic acid bacteria present in fermented foods are highly potent agonists of human hydroxycarboxylic acid receptor 3. PLoS Genet. 15, e1008145
Sivamaruthi BS, Kesika P, Chaiyasut C (2019) Toxins in fermented foods: prevalence and preventions – A mini review. Toxins 11, 4
Tamang JP, Watanabe K, Holzapfel WH (2016) Review: Diversity of microorganisms in global fermented foods and beverages. Front Microbiol 7, 377
Tarvainen M, Fabritius M, Yang B (2019) Determination of vitamin K composition of fermented food. Food Chem 275, 515–522
Taylor B C et al (2020) Consumption of fermented foods is associated with systematic differences in the gut microbiome and metabolome. mSystems 5, e00901-19
BACTERIS: 21 fílums principals, amb 147 gèneres importants
Click here for the English version: “BACTERIA, 21 main phyla, with 147 important genera”
16 maig 2023 ACTUALITZACIÓ de versió 7 abril 2020
CANVIS en la nomenclatura dels fílums, i de Lactobacillus
Des que el 2020 vaig escriure aquest article hi han hagut 2 revisions importants en la nomenclatura taxonòmica dels bacteris, i procariotes en general:
En primer lloc, just pel març 2020 es va publicar (Zheng et al. 2020) la proposta de reclassificació i nomenclatura taxonòmica de l’extremadament divers gènere Lactobacillus, en base sobretot a la filogènia de les seqüències genòmiques completes de la majoria de les fins aleshores 261 espècies incloses. Amb la proposta, ara són 25 gèneres, i espècies molt conegudes han canviat el nom del gènere mantenint el d’espècie, com Levilactobacillus brevis, Lacticaseibacillus casei, Lactiplantibacillus plantarum, Limosilactobacillus reuteri o Latilactobacillus sakei. Alguns s’han mantingut amb el mateix nom de gènere, com Lactobacillus acidophilus, Lactobacillus delbrueckii o Lactobacillus helveticus. A la proposta també s’ha inclòs l’anterior família de Leuconostocaceae dins les Lactobacillaceae.
L’altre revisió important, i fins a cert punt més costosa d’admetre, és la publicació l’octubre 2021 (Oren & Garrity 2021) d’una nota taxonòmica dels nous noms de 42 fílums, amb uns canvis importants aplicats a les regles del International Code of Nomenclature of Prokaryotes, de tal manera que els noms dels fílums acabin en -ota, en base al gènere tipus. Amb això, ara els Firmicutes són Bacillota, els Actinobacteria són Actinomycetota, els Bacteroidetes són Bacteroidota, els Deinococcus-Thermus són Deinococcota, els Tenericutes són Mycoplasmatota, els Proteobacteria són Pseudomonadota, els Verrucomicrobia són Verrucomicrobiota, i així successivament.
A les Figures de moment encara he mantingut els noms antics dels fílums, i al llistat a continuació he afegit els noms nous darrera els antics.
—————————————————
Si voleu anar directament a l’arbre filogenètic simplificat (Figura 4) que proposo més a baix, cliqueu aquí. Ídem per a la relació dels 21 fílums. Ídem per al llistat alfabètic de gèneres.
Propòsit d’aquest article
Més d’un cop alguns alumnes m’han comentat que quan a classe o en fer algun treball bibliogràfic, els apareix un nom d’un gènere microbià que no els és gaire familiar, no tenen clar on trobar quin tipus de microorganisme és i/o quines són les seves característiques bàsiques, a banda de recórrer a la Wikipedia o Viquipèdia. Encara que n’hi ha abundant bibliografia, i per a consultes només d’ubicació filogenètica d’un determinat gènere jo faig anar l’apartat Taxonomy del National Center for Biotechnology Information (NCBI), a mi mateix em passa que sovint trobo a faltar una font d’informació que sigui fàcil i ràpida de consultar, i que no caldria que fos massa exhaustiva.
Aquest és el propòsit d’aquest article del meu blog: fer un resum dels principals fílums bacterians, amb la relació dels gèneres més importants. Aquests són els que semblen més rellevants, sobretot per aspectes beneficiosos, a nivell ambiental o en aliments i altres aplicacions industrials, també alguns pels seus metabolismes característics, i també alguns dels patògens més coneguts.
Per no fer-ho massa exhaustiu, de moment aquí em limito als bacteris, i per tant no es consideren ni arqueus, ni microorganismes eucariotes, ni virus.
Taxonomia i filogènia dels Bacteris
La taxonomia és la ciència d’anomenar, definir i classificar els grups de sers vius en base a les característiques que comparteixen. Aquests grups són els tàxons, que es distribueixen en categories jerarquitzades, que són (variables segons els organismes): Domini, Regne, Fílum (SCB 2009-210), Classe, Ordre, Família, Gènere i Espècie. Com sabeu, el primer sistema taxonòmic fou desenvolupat al segle 18 per Carl von Linné, que establí els fonaments de la nomenclatura binomial (Gènere + espècie).
Després de Linné, la taxonomia es desenvolupà gràcies sobretot a Ernst Haeckel (segle 19) i Robert Whittaker, que va proposar els 5 regnes: els 4 eucariotes (Animals, Plantes, Fongs i Protistes) més el dels Monera, els procariotes, bacteris bàsicament (Whittaker 1969).
Encara que es podrien establir classificacions taxonòmiques només en base a les característiques fenotípiques (morfologia, estructures, metabolismes, etc.), actualment la taxonomia s’elabora veient les relacions de parentesc entre els organismes i la seva història evolutiva, o sigui la filogènia, realitzant arbres filogenètics, que es basen en les semblances genètiques, que expliquen l’evolució dels organismes, tant els actuals com els extingits.
Històricament, abans dels coneixements moleculars, la classificació o taxonomia dels bacteris va presentar moltes dificultats i errors, donades les seves dimensions microscòpiques i la manca de trets morfològics fàcils de distingir, al contrari de plantes i animals. La classificació es basava només en la forma, estructura de la paret cel·lular (Gram) i els metabolismes, però no es podia realitzar un arbre filogenètic.
Això va canviar de la mà de Carl Richard Woese (1987), iniciador de la revolució filogenètica molecular, que va classificar tots els organismes (no només els bacteris), en base a les seqüències del RNA ribosòmic, definint per primer cop els arqueobacteris (ara Archaea o arqueus), i per tant introduint el concepte dels tres dominis (Figura 1).

Figura 1. Arbre filogenètic universal dels 3 dominis (Archaea o Arqueus (SCB 2009), Bacteris i Eucariotes), determinat comparant les seqüències dels rRNA, on les llargades de les línies són proporcionals a les distàncies calculades per alineament dels rRNA (Woese 1987).
Limitant-nos als Bacteris, en base al 16S rRNA Carl Woese n’establí 11 divisions (Figura 2).
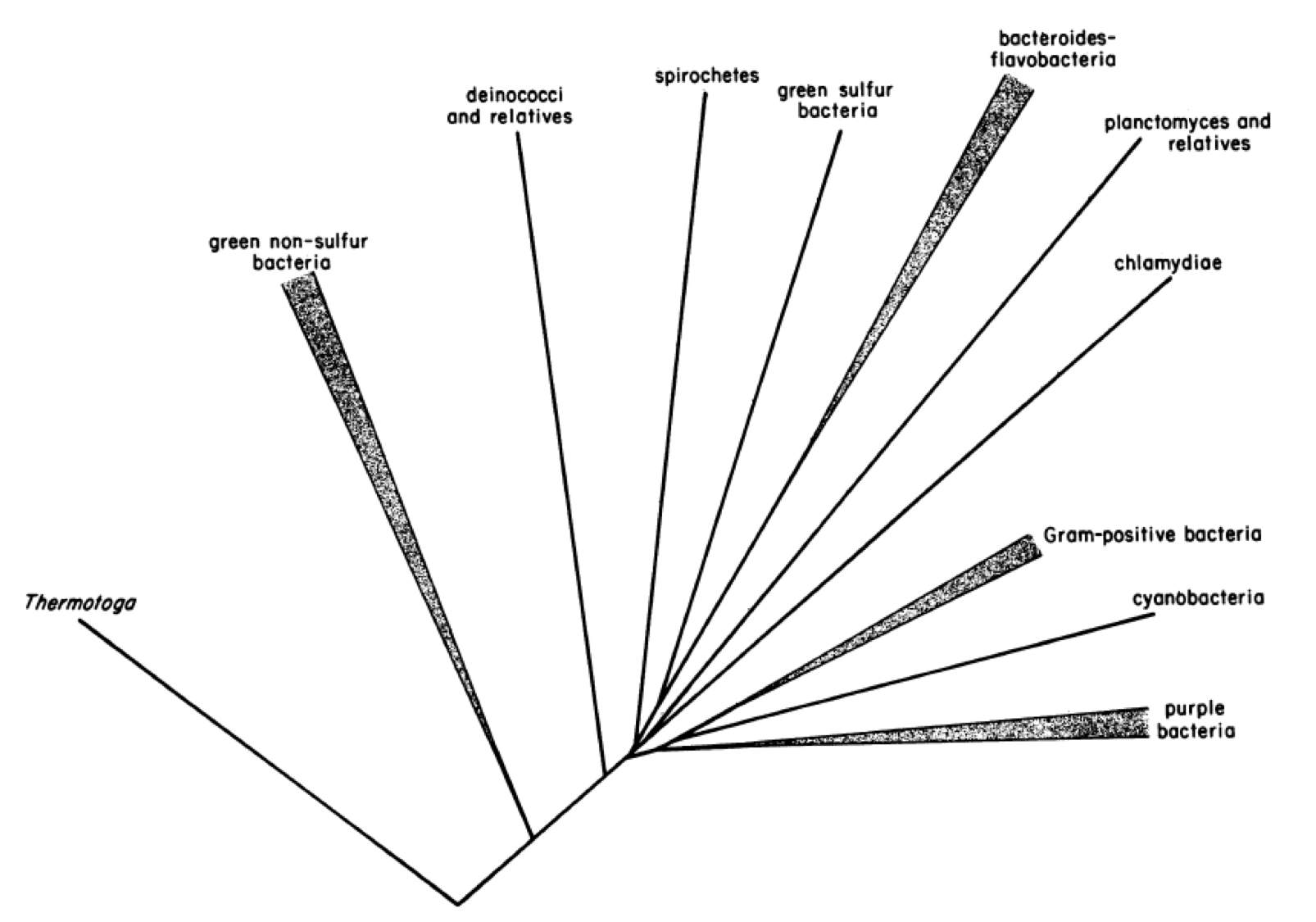
Figura 2. Arbre filogenètic dels bacteris determinat comparant les seqüències dels rRNA 16S, on les llargades de les línies són proporcionals a les distàncies calculades per alineament dels 16S i el punt d’origen és una seqüència consens dels arqueus (Woese 1987).
Després de Woese, a nivell de bacteris aquest arbre filogenètic s’ha anat modificant, per una banda incorporant-hi nombrosos grups de bacteris descoberts, sobretot termòfils, quimiolitòtrofs i altres d’ambients extrems. I d’altra banda, el desenvolupament de les tècniques no dependents de cultiu ha permès detectar nombrosos bacteris sense haver d’aïllar-los. Entre aquestes tècniques on es pot analitzar directament el DNA de mostres ambientals, cal senyalar els mètodes de metagenòmica, que amplifiquen i seqüencien fragments dels gens (16S o altres) de tots els bacteris presents i es tracten les dades amb programes bioinformàtics per comparar uns amb altres i deduir les possibles noves espècies.
Coetàniament a Woese, la classificació de tots els sers vius va ser millorada per Thomas Cavalier-Smith, sobretot a nivell dels protistes (Cavalier-Smith 1993). Alguns dels arbres recents més complets de bacteris s’han basat en comparar alguns gens més conservats, com Lang et al (2016), que proposa diferents models de superarbres de 3000 procariotes seqüenciats en base a 24 gens.
En base a tot això, un dels arbres filogenètics més recents és el proposat per Hug et al. (2016), que ha estat elaborat en base a les seqüències publicades, incloses les dades genòmiques de 1000 organismes poc coneguts i no aïllats en cultius. Aquest “arbre de la vida” amb els 3 dominis de bacteris, arqueus i eucariotes revela una predominança de la diversificació bacteriana i subratlla la importància d’organismes dels quals no es tenen representants aïllats (Figura 3). Per a aquest arbre foren utilitzats 30437 genomes d’espècies dels 3 dominis disponibles a les bases de dades del NCBI pel setembre 2015. Actualment (març 2020) ja consten 50159 espècies seqüenciades al NCBI: 1724 arqueus, 26467 bacteris, 4915 eucariotes i 17053 virus.

Figura 3. Visió actual de l’arbre de la vida, englobant la diversitat total de genomes seqüenciats, amb 92 fílums bacterians, 26 d’arqueus i els 5 supergrups eucariotes (Hug et al. 2016)
En anar comparant les seqüències genètiques de molts bacteris s’ha anat veient la dificultat d’elaboració dels arbres filogenètics evolutius amb branques com sempre els representem, perquè la transferència genètica horitzontal (TGH) és un fenomen habitual als bacteris. Mitjançant els mecanismes de transformació, transducció vírica i conjugació, els bacteris comparteixen molts gens en la seva evolució, i desdibuixen les branques, de tal manera que la representació hauria de ser més semblant a una xarxa. Per tant, cal prendre’s les representacions dels fílums en branques evolutives com una aproximació relativa.
El recurs bibliogràfic més important per a la determinació, identificació i sistemàtica de tots els organismes procariotes, o sigui Bacteris i Arqueus, ha estat sens dubte el Manual Bergey. Iniciat el 1923 per David H. Bergey, lògicament ha tingut successives actualitzacions i ampliacions, mantenint la importància de ser el Manual de referència per a la descripció de totes les característiques dels procariotes. La darrera versió publicada en paper del Bergey’s Manual of Systematic Bacteriology comprèn 5 volums en 7 llibres (2001-2012). Més recentment s’ha publicat una versió online (Whitman, 2015).
Un altre recurs valuós és la base de dades LPSN (List of Prokaryotic Names with Standing in Nomenclature) (Parte 2014), que recull el llistat online de tots els noms dels procariotes que han estat validats per publicació al International Journal of Systematic and Evolutionary Microbiology, sota les regles del Codi Internacional de Nomenclatura de Bacteris. Actualment, a la LPSN hi han llistats 15974 tàxons, distribuïts en 41 fílums bacterians més 5 d’arqueus. A més, la LPSN inclou la classificació actualitzada dels procariotes, la seva nomenclatura, i de les col·leccions de cultiu.
Tanmateix, tant el Bergey com el LPSN són massa exhaustius i poc pràctics per fer una cerca ràpida d’algun gènere bacterià concret, o tenir una visió ràpida global de les relacions filogenètiques entre diversos fílums.
La meva proposta simplificada de l’arbre filogenètic dels Bacteris
En base a l’arbre comentat de Hug et al (2016) (Figura 3), limitant-nos als bacteris, he gosat fer-ne una simplificació, prescindint dels fílums no gaire coneguts o de les nombroses branques sense representants aïllats en cultiu. Amb això, queden els 21 fílums principals que veiem a la Figura 4.
Com he comentat al principi (16 maig 2023) els noms del fílums s’han canviat (Oren & Garrity 2021) i ara acaben tots en -iota en base al nom del genus tipus. Els canvis més manifestos són per exemple Firmicutes per Bacillota, i Proteobacteria per Pseudomonadota. A les Figures encara no he canviat els noms antics, però al llistat que vé a continuació he afegit als noms nous al darrera els antics.
……………
Com veiem a la Figura 4, Terrabacteria i Hydrobacteria són dues categories taxonòmiques superiors que inclouen la gran majoria de fílums bacterians, el 99% de bacteris. Els Terrabacteria haurien evolucionat adquirint adaptacions de resistència a condicions ambientals terrestres com dessecació, radiació UV, alta salinitat, incloent una paret cel·lular característica (grampositius) i altres d’ells haurien desenvolupat la fotosíntesi oxigènica (els cianobacteris). Els Hydrobacteria serien la resta de bacteris, la majoria de gramnegatius, que haurien evolucionat en ambients aquosos o humits, i inclouen els 2 superfílums FCB (Fibrobacter–Chlorobi–Bacteroides) i PVC (Planctomyces–Verrucomicrobia–Chlamydia), i el gran grup de Proteobacteris. Els supertàxons Terrobacteria i Hydrobacteria haurien divergit fa 3000 milions d’anys, quan els Terrabacteria haurien començat a colonitzar els continents.
A la mateixa Figura 4 he senyalat els protomitocondris i protocloroplasts, que van sorgir dels fílums Alfaproteobacteria i Cyanobacteria respectivament, fa uns 1500-2000 milions d’anys.

Figura 4. Visió actual simplificada de l’arbre filogenètic dels bacteris amb 21 principals fílums, elaborat en base al conjunt de seqüències del DNA de 16 proteïnes ribosomals (modificada de Hug et al 2016). LUCA: últim avantpassat comú universal (Last Universal Common Ancestor).
——————————
RELACIÓ dels 21 FÍLUMS principals dels bacteris: característiques i gèneres més importants
Com he comentat al principi (16 maig 2023) els noms del fílums s’han canviat (Oren & Garrity 2021) i ara acaben tots en -iota en base al nom del genus tipus. En aquest llistat he conservat els noms antics i he afegit els nous noms.
A continuació descric mínimament els 21 fílums (Figura 4), seguint l’arbre filogenètic de dreta a esquerra. Per als tàxons (classes, ordres) més rellevants que comento dins d’algun dels fílums, he seguit les categories tal com estan al NCBI (Taxonomy). He resumit les descripcions en base a les fonts bàsiques d’informació de Microbiologia, com el Brock (Madigan et al. 2017), Lengeler et al. (1999), Tortora et al. (2018), o el Prescott (Willey et al. 2017), i dins dels recursos més habituals d’internet, a més de la Wikipedia, també cal senyalar el MicrobeWiki.
1. Aquificae = Aquificota
Com Aquifex o Hydrogenobacter, és un fílum proper a Thermotogae, i ambdós són els bacteris més propers als arqueus. Són bacils gramnegatius, hipertermòfils, quimiolitòtrofs aerobis, oxiden H2 produint H2O, i es troben en aigües calentes o volcàniques.
2. Thermotogae = Thermotogota
Com Thermotoga, és un fílum proper a Aquificae. Són hipertermòfils, anaerobis fermentatius, bacils gramnegatius, amb un embolcall tipus “toga”, i es troben en aigües calentes i xemeneies hidrotermals.
3. Deinococcus – Thermus = Deinococcota
És un fílum de bacteris molt resistents a ambients extrems, per tant extremòfils, que inclou 2 grups dels quals els gèneres més coneguts són els que donen nom al fílum:
Deinococcus són cocs grampositius amb paret gruixuda, amb segona membrana, resistents a raigs gamma i UV, de color rosa pel pigment carotenoide deinoxantina.
Thermus són bacils gramnegatius hipertermòfils, es troben en fonts termals, i també al compostatge. Th. aquaticus fou aïllat per Thomas D. Brock (el del llibre) i H. Freeze, de les aigües termals amb guèisers de Yellowstone, i és molt conegut per la DNA-polimerasa Taq, molt utilitzada a les PCR perquè no es desnaturalitza a 95ºC. Th. thermophilus, també amb DNA-polimerases termostables, és un model per a la manipulació genètica.
4. Cyanobacteria = Cyanobacteriota
Els cianobacteris abans eren coneguts com “algues verd-blaves” o cianofícies, perquè són filamentosos i fan fotosíntesi, com les algues i les plantes. Com aquestes, fan fotofosforilació no cíclica, amb 2 fotosistemes i clorofil·la. De fet, són l’origen evolutiu dels proto-cloroplasts, van “inventar” la fotosíntesi oxigènica, són els únics bacteris que la fan actualment, i van generar l’atmosfera tal com la coneixem fa uns 2700 milions d’anys. Els estromatòlits fòssils formats per biopel·lícules de cianobacteris són els indicis més antics de vida a la Terra. Són filaments gramnegatius, amb membranes internes. Alguns fixen N2 en cèl·lules especialitzades (heterocists) més gruixudes que contenen la nitrogenasa. Són a molt diversos hàbitats, tant terrestres com aquàtics, alguns són simbionts de plantes, altres fan cianotoxines, i són els principals causant de blooms en aigües eutròfiques. Alguns són menjar, font de nutrients (Spirulina). Amb metabolisme secundari molt actiu, també són font interessant d’antivirals, antibiòtics i antitumorals. Altres gèneres són: Anabaena, Chroococcus, Nostoc, Oscillatoria, Pleurocapsa i Synechococcus.
5. Firmicutes = Bacillota
Són un gran fílum de grampositius, bacils o cocs, quimioheteròtrofs, amb baix contingut de G+C al DNA (la majoria amb <50%). Inclou sobretot 3 grans classes, Bacilli, Clostridia i Negativicutes:
Bacilli amb 2 ordres, Bacillales i Lactobacillales:
Bacillales, que són aerobis o facultatius, amb respiració aeròbica sobretot. Gèneres importants:
Bacillus, bacils formadors d’endòspores, ubics als ambients terrestres, on junt amb Paenibacillus afavoreixen els conreus vegetals (vegeu el meu post sobre l’agromicrobioma). L’esporulat més resistent és B. stearothermophilus, model dels càlculs d’esterilització tèrmica. Cal destacar-ne els patògens B. anthracis (àntrax maligne o carboncle) i B. cereus (intoxicacions alimentàries). Moltes espècies són d’interès industrial: producció d’enzims (com amilasa) o proteases (subtilisina de B. sutilis), antibiòtics peptídics, alguns són probiòtics d’aus (vegeu el meu post sobre Bacillus probiòtics), i B. thuringiensis és molt utilitzat com a bioinsecticida per les seves toxines Cry i els seus gens incorporats en plantes modificades genèticament Bt (cotó, moresc i altres).
Listeria, bacils anaerobis facultatius no formadors d’endòspores, sapròfits però també patògens oportunistes (L. monocytogenes) i resistents al fred, són la primera causa de mort entre les malalties de transmissió alimentària.
Staphylococcus, cocs anaerobis facultatius agrupats en forma de raïm, habituals comensals a la pell i mucoses membranoses. Alguns són patògens degut a la formació de coagulasa.
Lactobacillales: són els bacteris làctics (BL) o de l’àcid làctic. Vegeu la nota inicial afegida pel maig 2023 sobre la reclassificació, en base a Zheng et al. (2020). Són bacils o cocs, anaerobis aerotolerants, amb metabolisme fermentatiu, produint sobretot àcid làctic a partir de sucres. No esporulats, són presents en plantes en descomposició (sobretot Lactobacillus) i als productes lactis (sobretot Lactococcus, Lactobacillus i Streptococcus). Són molt importants industrialment, com a agents actius de molts aliments fermentats (derivats de llets, vegetals, carns, peixos, vins i cerveses, etc.), coneguts en conjunt com a productes làctics, on aquests bacteris contribueixen a conservació, per baixada del pH i producció de bacteriocines, i qualitats organolèptiques. Per això són globalment considerats com a GRAS (Generally Recognized as Safe). A més, també tenen un paper rellevant a la microbiota saludable animal i humana, tant al digestiu com a les superfícies mucoses. Per això alguns d’ells són dels probiòtics més usuals, sobretot Lactobacillus. D’altra banda, Oenococcus és el gènere exclusiu dels vins, on du a terme la fermentació malolàctica (aquí teniu un petit resum), una fermentació peculiar lligada a ATPasa. Altres gèneres importants de BL són: Enterococcus (alguns poden ser patògens i altres probiòtics), Leuconostoc, Pediococcus (present a cerveses, vegeu el meu post sobre BL de cerveses), Weissella, Carnobacterium, Aerococcus i Fructobacillus.
Clostridia
Són bacils anaerobis estrictes formadors d’endòspores. Són sapròfits, fermentant sobretot polisacàrids vegetals, i viuen sobretot als sòls. Alguns són patògens oportunistes freqüents al digestiu (Clostridium difficile) o sapròfits de teixits que poden causar gangrena (C. perfringens) i els pitjors produeixen algunes de les toxines més perilloses: C. tetani i C. botulinum. En canvi, són molt abundants a la microbiota intestinal saludable (vegeu el meu post) i per tant possibles probiòtics (Clostridium, Eubacterium, Coprococcus i Ruminococcus, productors dels beneficiosos butirat i propionat), i sobretot Faecalibacterium prausnitzii o Christensenella, associats a baix índex corporal i poc greix.
Encara que de la mateixa classe Clostridia i també anaerobis esporulats, el gènere Heliobacteria són fotoheteròtrofs anoxigènics (amb bacterioclorofil·la g, un fotosistema i fotofosforilació cíclica), no són grampositius i fixen N2.
Negativicutes
Són anaerobis esporulats, propers filogenèticament als Clostridia, però gramnegatius, ja que tenen una membrana externa semblant a la dels proteobacteris (possible transferència genètica horitzontal). Selenomonas té forma de mitja lluna, és mòbil, present al rumen dels remugants. Veillonella és un coc de l’intestí humà, beneficiós perquè fermenta lactosa donant acetat i propionat. Phascolarctobacterium i Megasphaera són bacils pleomòrfics que també produeixen aquests àcids grassos de cadena curta a l’intestí, i per tant, també beneficiosos.
6. Tenericutes = Mycoplasmatota
Fílum proper als Firmicutes, però no tenen paret cel·lular. Classe única: Mollicutes. Són molt petits de mida (0,2-0,3 µm), i de genoma (0,6 Mbp), perquè són paràsits intracel·lulars d’animals i plantes, sapròfits i/o patògens. En no tenir paret cel·lular, són resistents a molts antibiòtics. De forma variable, poden viure sense oxigen. Els Mycoplasma són patògens humans que poden causar pneumònia o infeccions de transmissió sexual.
7. Chloroflexi = Chloroflexota
Com Chloroflexus, també són anomenats bacteris verds no-sofre o clorobacteris, són filamentosos o lliscants, amb membranes internes (clorosomes). Són fotoheteròtrofs anoxigènics (amb bacterioclorofil·la cs, un fotosistema i fotofosforilació cíclica). Són gramnegatius però sense membrana externa. La classe Thermomicrobia inclou els que són termòfils (Thermomicrobium), alguns amb pigment rosa.
8. Actinobacteria = Actinomycetota
Són un altre gran fílum de grampositius, heteròtrofs, tant aerobis com anaerobis, amb alt contingut de G+C al DNA (la majoria amb >50%), de formes irregulars i alguns filamentosos. Són molt versàtils catabòlicament i ubics a ambients terrestres i aquàtics. Inclou aquests ordres principals:
Actinomycetales, com Actinomyces, són anaerobis facultatius, poden fer endòspores, són filamentosos però alguns bacils. Són uns dels microorganismes econòmicament més importants als sòls, tant agrícoles com forestals. Descomponen la matèria orgànica, juntament amb els fongs, als quals s’assemblen perquè formen micelis filamentosos.
Bifidobacteriales, anaerobis, fermenten carbohidrats, són bacils irregulars, sobretot bífides, ex. Bifidobacterium. Són importants a la microbiota intestinal de mamífers, als humans sobretot als infants, utilitzats com a probiòtics.
Corynebacteriales, aerobis, bacils més o menys irregulars, alguns en forma de porra i altres a vegades fan hifes. Abundants en diferents ambients terrestres, alguns són importants industrialment com a productors d’aminoàcids, com glutàmic i lisina (Corynebacterium glutamicum). Altres són patògens: C. diphtheriae, Mycobacterium tuberculosis (vegeu el meu post), M. leprae, i alguns oportunistes de baixa virulència com Nocardia.
Frankiales, filamentosos, com Frankia, viuen simbiòticament fixant N2 en nòduls a les arrels de molts tipus d’angiospermes.
Micrococcales, amb gèneres com: Micrococcus, cocs presents en aigües i sòls, sapròfits i oportunistes, útils per a biodegradació de contaminants, i alguns en productes càrnics, amb cists molt resistents (vegeu el meu post sobre persistència de microbis); Cellulomonas, bacils del sòl degradadors de cel·lulosa gràcies a glucanases; Arthrobacter (sinònim Siderocapsa) són bacils i cocs aerobis comuns al sòl, alguns per a producció de glutàmic i per a bioremediació, s’han descrit fins i tot alguns degradadors del polímer niló, i el seu DNA és dels més persistents al permafrost, més de 300.000 anys (vegeu el meu post ). Brevibacterium linens és ubic a la pell humana, produeix tioèsters típics de pudor de peus, i a més s’utilitza a formatges (Munster, Limburger, etc).
Propionibacteriales, com Propionibacterium, bacils anaerobis que sintetitzen propiònic a partir de sucres i també d’àcid làctic. També poden utilitzar el fumarat per una fermentació peculiar amb ATPasa. Presents a la microbiota intestinal i la pell d’animals, alguns són els causants de l’acne humana (reclassificats com Cutibacterium acnes) (vegeu també el meu post sobre bacteris de l’acne a la vinya). Altres són importants per a la producció de vitamina B12 i als productes lactis, sobretot formatges com els suïssos amb “ulls” (Emmental i altres).
Streptomycetales, amb l’important gènere Streptomyces, són els Actinobacteria més coneguts, amb més de 500 espècies. Aerobis, formen un complex miceli d’hifes ben desenvolupades i es dispersen amb espores aèries a partir d’estructures comparables als fongs micelials, però procariotes. Abundants al sòl i vegetació en descomposició, produeixen geosmina i 2-metilisoborneol, que donen el característic olor “de terra”, compostos que atrauen invertebrats els quals ajuden als bacteris a dispersar les seves espores. Tenen un complex metabolisme secundari, i per això són molt importants industrialment: antibiòtics antibacterians (estreptomicina, neomicina, tetraciclina, etc.), antifúngics (nistatina), antiparasitaris, anticancerosos i també per a l’expressió heteròloga de proteïnes eucariòtiques.
9. Fibrobacteres = Fibrobactecterota
Ja dins els Hydrobacteria (Figura 4), junt amb Chlorobi i Bacteroidetes són el superfílum FCB, abans anomenats com a fílum Sphingobacteria per Cavalier-Smith. Són bacils gramnegatius anaerobis estrictes. Inclouen uns dels principals bacteris cel·lulolítics del rumen dels remugants, com Fibrobacter. Degraden sobretot beta-glucans, produint formiat, acetat i succinat.
10a. Chlorobi = Chlorobiota
Del superfílum FCB, es consideren un sol fílum junt amb Bacteroidetes. Són sobretot els bacteris verds del sofre, bacils o cocs gramnegatius, anaerobis estrictes fotoautòtrofs que fan la fotosíntesi anoxigènica, amb bacterioclorofil·les situades en clorosomes i la membrana plasmàtica. Tenen un fotosistema, i utilitzen sulfurs com donador d’electrons. Capten CO2 pel cicle invers del cítric. Poden produir sulfats o acumular S elemental a l’exterior cel·lular. Chlorobium es troben als fons marins i dels llacs, i són abundants per ex. al Mar Negre.
10b. Bacteroidetes = Bacteroidota
També del superfílum FCB i mateix fílum que Chlorobi, són bacils gramnegatius (amb membrana externa) anaerobis estrictes, no esporulats, exclusius del tracte gastrointestinal d’animals, on són dels bacteris més abundants, sobretot Bacteroides i també Prevotella, i on metabolitzen carbohidrats (polisacàrids sobretot) i altres compostos com les sals biliars, produint àcids grassos de cadena curta, beneficiosos per a l’hoste (vegeu el meu post sobre Bacteroides). Tanmateix, alguns poden ser patògens si passen a òrgans fora del digestiu. Sembla que la ratio Prevotella/Bacteroides en humans és més alta en dietes altes en fibra i menor pes corporal. Flavobacterium és un Bacteroidetes conegut patogen de peixos.
11. Planctomycetes = Planctomycetota
Del superfílum PVC, són bacteris gramnegatius anaerobis particulars, ex. Planctomyces: ovoides amb un apèndix pseudo-tija acabada en una estructura adherent al substrat, amb invaginacions de la membrana que recorden les estructures cel·lulars eucariotes i paret cel·lular amb quasi gens de glicopèptid. Es reprodueixen per gemmació, generant formes flagel·lades lliures que acaben essent sèssils. Viuen en aigües, tant dolces com marines i salobres. Alguns com Brocardia contenen una estructura membranosa, anammoxosoma, on té lloc l’oxidació anaeròbica d’amoni (Anammox) amb nitrit, produint N2, metabolisme important per al cicle del N.
12a. Verrucomicrobia = Verrucomicrobiota
També del superfílum PVC, i considerats del mateix fílum amb Chlamydiae, n’hi ha poques espècies descrites. Tenen formes similars a berrugues i són gramnegatius anaeròbics, aïllats del sòl, aigües i de femta humana. Akkermansia, aerotolerant, a la microbiota de l’intestí humà, s’ha relacionat amb menor obesitat i menor incidència de malalties relacionades, gràcies a mantenir la capa mucosa degradant mucina, contribuint a la funció de barrera.
12b. Chlamydiae = Chlamydiota
També del superfílum PVC i fílum amb Verrucomicrobia, són cocs gramnegatius, obligats intracel·lulars d’eucariotes, molts patògens d’animals i alguns simbionts de protozous. Presenten dues formes (com els virus): l’extracel·lular, particulada o cos elemental, de només 0,3 µm, que per endocitosi genera la forma reticulada intracitoplasmàtica, de 0,5 µm. Les infeccions per Chlamydia són la malaltia bacteriana de transmissió sexual més freqüent.
13. Acidobacteria = Acidobacteriota
Com Acidobacterium, són bacils gramnegatius aerobis o facultatius o anaerobis, heteròtrofs, molts d’ells oligòtrofs, majoria són acidòfils (pH 3-6), i tenen càpsules amb molt d’exopolisacàrid. Encara que són poc aïllats en cultiu, són ubics, especialment als sòls, on arriben a ser el 50% dels bacteris, on molts són simbiòtics a la rizosfera de les plantes. Alguns són bons biodegradadors de compostos aromàtics (Holophaga) i/o captadors de metalls (Geothrix).
14. Nitrospirae = Nitrospirota
Fílum monofilètic, són gramnegatius aerobis de forma helicoïdal o de coma (vibrió). Difícils d’aïllar, són presents en ecosistemes marins formant biofilms però també en terrenys humits o fangs actius de depuradores, biofiltres i altres. És nitrificant, fent oxidació de nitrits, ex. Nitrospira.
“Proteobacteria” = Pseudomonadota i altres
Com veiem a la Figura 4, el nom de gran part dels fílums restants contenen aquest terme. Constitueixen el grup més gran i metabòlicament més divers de bacteris, i tenen en comú ser gramnegatius amb membrana externa de lipopolisacàrids. Són quasi la meitat dels procariotes seqüenciats, i inclouen tant fotòtrofs com heteròtrofs amb un origen evolutiu comú, que se suposa serien fotòtrofs anoxigènics com els bacteris porpra (ex. Rhodospirillum). Per això i per tenir una relació filogenètica en base al 16S, Woese (1987) els va anomenar “Bacteris Porpra i relacionats” i va establir les primeres subdivisions alfa, beta, gamma i delta. Poc després Stackebrandt et al (1988) van proposar aquest terme Proteobacteria, basat en el déu grec Proteu, per l’analogia amb que aquest que podia adoptar múltiples formes.
15a. Deltaproteobacteria = Myxococcota
Considerats fílum comú amb Thermodesulfobacteria, inclouen dos grups:
Els mixobacteris (ordre Myxococcales), aerobis que viuen als sòls, heteròtrofs de matèria orgànica insoluble, que es mouen per lliscament. Tenen genomes molt grans respecte a altres bacteris, de 10 Mbp, algun fins a 16 Mbp. El cicle biològic (Myxococcus per ex.) és complex: les formes vegetatives són bacils lliscants que s’agrupen en cossos fructífers (per quorum sensing de contacte) de diferents formes i colors, i que donen mixòspores esfèriques resistents. Alguns són productors d’antibiòtics i altres com Sorangium, també de fàrmacs antitumorals.
L’altre gran grup són els anaerobis estrictes relacionats amb el sofre. La reducció desassimiladora de sulfats en ambients marins i de depuració d’aigües suposa el 50% de la mineralització de matèria orgànica. Inclou aquests dos ordres:
Desulfovibrionales, els principals bacteris reductors de sulfats: Desulfovibrio, Desulfobacter i altres. Són bacils o bacils corbats flagel·lats que viuen en ambients aquosos, on degraden matèria orgànica, mitjançant la respiració anaeròbia utilitzant sulfat com a acceptor d’electrons. Produeixen SH2, que a més de fer pudor, reacciona amb metalls, els corrou, i produeix per ex. FeS. Són considerats dels microbis més antics a la Terra, i molts importants en el cicle del S.
Desulforomonadales, són els reductors de sofre elemental, també per respiració anaeròbia, però que també poden utilitzar altres compostos inorgànics com nitrat, Fe3+ i altres metalls. També produeixen SH2. Geobacter és un dels principals gèneres, utilitzat per a biodegradació i bioremediació de contaminants, i que s’està estudiant per al disseny de piles microbianes que generin electricitat gràcies a la conductivitat dels biofilms que formen.
15b. Thermodesulfobacteria = Thermodesulfobacteriota
Mateix fílum que els Deltaproteobacteria. Són els reductors de sulfats termòfils i hipertermòfils, bacils aïllats de fonts termals, fons marins i xemeneies hidrotermals. El més conegut, Thermodesulfobacterium, té un lípid de membrana (fosfoaminopentanotetrol) que només es troba als arqueus. Geothermobacterium, aïllat a Yellowstone, té una temperatura òptima de 85-90ºC, la més alta dels bacteris, i redueix Fe3+.
16. Oligoflexia = Bdellovibrionota
Filogenèticament emparentats amb els Deltaproteobacteria, aquest fílum inclou Bdellovibrio i altres depredadors d’altres gramnegatius. Són bacils corbats (vibrions) petits (prop de 1 µm) aerobis, amb un flagel polar que els permet mobilitats de 100 vegades el seu cos per segon. En el seu cicle biològic, la forma lliure mòbil s’adhereix a un bacteri presa, li penetra, forma un complex esfèric amb l’hoste, utilitza hidrolases per digerir proteïnes i DNA de l’hoste, i hi creix en forma de filament, lisa l’hoste i el filament se separa en 3-6 cèl·lules filles lliures, tot en 4 h.
17. Spirochaetes = Spirochaetota
Les espiroquetes són bacteris gramnegatius amb membrana externa, de forma característica espiral o helicoïdal, força llargs (de 3 a 200 µm), degut al filament axial, conjunt de flagels, situat a l’espai periplàsmic. Aquest filament es contrau, permetent la mobilitat. Són heteròtrofs anaerobis o facultatius d’ambients aquàtics diversos. Spirochaeta és de vida lliure i no patogen, però altres gèneres ho són, com Leptospira (leptospirosi), Borrelia (malaltia de Lyme per les paparres) o Treponema (sífilis i malalties tropicals).
18. Epsilonproteobacteria = Campylobacterota, classe Epsiloproteobacteria
Són gramnegatius heteròtrofs, la majoria microaeròfils, mòbils i de formes corbades, espirals o helicoïdals, i els més coneguts són simbionts o patògens al tracte digestiu d’animals, humans inclosos. Campylobacter és patògen sobretot del bestiar, i d’origen alimentari als humans. Helicobacter és molt freqüent a l’estómac causant úlceres i gastritis. Arcobacter és un patogen emergent que a més de trobar-se al digestiu d’animals, pot ser contaminant de mariscs.
El fílum també inclou força aïllats no patògens aïllats de xemeneies hidrotermals i de les fosses submarines, com Sulfurimonas.
19. Alphaproteobacteria = Pseudomonadota, classe Alphaproteobacteria
Gran i molt divers fílum de gramnegatius amb membrana externa a la paret cel·lular. Junt amb betaproteobacteris i gammaproteobacteris constitueixen un clar grup monofilètic, d’origen comú, i serien les Proteobacteria mes típiques (Figura 4). El conjunt dels 3 fílums va ser nomenat com Rhodobacteria per Cavalier-Smith el 1987.
Els alfaproteobacteris inclouen els principals ordres següents:
Rhodobacterales , com Rhodobacter, model d’estudi de la fotosíntesi bacteriana anoxigènica. Són dels anomenats bacteris porpra (pel seu color resultant de les bacterioclorofil·les més els carotens) de no-sofre, per diferenciar-los del porpra de sofre (les Chromatiales dins els gammaproteobacteris). Tenen gran diversitat de metabolismes: fotosíntesi, litotròfia i respiració aeròbia i anaeròbica, i són presents en tots els ambients aquosos.
Rhodospirillales, que inclou també bacteris porpra no-sofre (Rhodospirillum) amb àmplies capacitats metabòliques i forma d’espiral. També ho són els bacteris acètics (Acetobacter, Gluconobacter, Gluconacetobacter, Komagataeibacter i altres), bacils aerobis ben coneguts pel metabolisme oxidatiu respiratori, oxidant sucres i etanol a àcid acètic, produint els vinagres. També ho és Magnetospirillum, microaeròfil de forma espiral, que conté els magnetosomes, orgànuls amb magnetita (Fe3O4), que els permeten orientar-se amb el camp geomagnètic.
Caulobacterales, com Caulobacter, de forma corbada i oligotròfics d’aigua dolça. Tenen un característic cicle cel·lular amb dues formes diferenciades: una amb peduncle adherit a un substrat, que en dividir-se asimètricament genera una forma lliure flagel·lar que acaba passant a forma pedunculada.
Magnetococcales, amb Magnetococcus, cocs marins amb característiques similars a Magnetospirillum, inclosos els magnetosomes.
Rhizobiales, amb Rhizobium, els ben coneguts fixadors de N2 endosimbionts als nòduls radiculars de les lleguminoses. Del mateix ordre són: Agrobacterium, causant de tumors en plantes per transferència del seu DNA, i per això molt utilitzat en enginyeria genètica (A. tumefaciens); Rhodopseudomonas, un altre bacteri porpra fotosintètic no-sofre d’aigües i sòls; Brucella, cocobacils petits patògens d’humans i altres animals; i Nitrobacter, bacils aerobis quimiolitòtrofs nitrificants, oxidant nitrit a nitrat.
Ricketssiales, són endosimbionts obligats de cèl·lules eucariotes, molts patògens, com Rickettsia, patogen humà pleomòrfic (cocs, bacils, etc.) transmès per artròpodes, i Wolbachia, que infecta moltíssims artròpodes i nematodes. Com he senyalat a la Figura 4, la relació filogenètica suggereix que els mitocondris (endosimbionts) es van desenvolupar a partir d’aquest grup.
Sphingomonadales, com Sphingomonas, bacils aerobis estrictes, amb glicoesfingolípids a membrana externa, enlloc dels lipopolisacàrids dels altres gramnegatius, i amb típiques colònies grogues. Presents a molts diversos ambients, on sobreviuen amb baixes concentracions de nutrients i una versàtil capacitat de biodegradar compostos, inclosos aromàtics i altres tòxics. Per això són usats per a bioremediació, i els seus polímers extracel·lulars (esfingans) són aprofitats a la indústria alimentària. Zymomonas són bacils anaerobis facultatius, amb la característica única entre bacteris de fer fermentació alcohòlica, al pulque mexicà o al vi de palma africà, degradant els sucres a piruvat mitjançant la via Entner-Doudoroff.
20. Betaproteobacteria = Pseudomonadota, classe Betaproteobacteria
Fílum divers, de grups aerobis o facultatius, de formes variades, amb versatilitat metabòlica, tant heteròtrofs com quimiolitòtrofs, i alguns fotòtrofs. Els principals ordres són:
Burkholderiales, la majoria són bacils aerobis mòbils: Burkholderia i Bordetella, patògens d’humans i altres animals; Ralstonia i Achromobacter són corrents als sòls i patògens oportunistes; Alcaligenes també són patògens oportunistes, i alguns produeixen el biopolímer polihidroxibutirat; Oxalobacter excepcionalment és anaeròbic, es troba a la microbiota humana i al rumen dels remugadors, on degrada l’oxàlic, beneficiant a l’hoste, per una fermentació peculiar amb ATPasa; Sphaerotilus natans són filamentosos (fins a 0,5 mm) embeinats heteròtrofs aerobis, presents en aigües contaminades i que impedeixen floculació de fangs actius; Acidovorax, conegut patogen de cultius de cucurbitàcies (carbassa, carbassó, cogombre, síndria, etc.); Ideonella sakaiensis és degradador del plàstic PET (vegeu meu post sobre bacteris que mengen plàstic).
Neisseriales, diplococs aeròbics no mòbils, colonitzen les mucoses de molts animals sense causar danys, i només dos espècies són patògens humans: Neisseria meningitidis i N. gonorrhoeae.
Nitrosomonadales, ordre divers amb uns quants quimiolitòtrofs aerobis bacils, com Nitrosomonas, el més conegut dels nitrificants, que oxida amoni a nitrit, o Thiobacillus, els coneguts bacteris oxidadors de sofre (incolors) i de Fe2+, i Gallionella, bacil helicoïdal i filamentós també oxidador de ferro però microaeròfil. Methylophilus són dels diversos organismes (bacteris i fongs) metilòtrofs, que utilitzen com a substrat compostos C1, com metanol, metà, per tant són beneficiosos al medi ambient. Spirillum són microaeròfils heteròtrofs en forma d’espiral, presents en aigües dolces amb matèria orgànica.
Rhodocyclales, en destaca Zoogloea, bacils aeròbics mòbils que són rellevants als tractaments aerobis d’aigües residuals, on degraden matèria orgànica i ajuden a formar els flocs que sedimenten als fangs actius.
21. Gammaproteobacteria = Pseudomonadota, classe Gammaproteobacteria
L’últim gran fílum de Proteobacteria, gramnegatius amb membrana externa a la paret cel·lular, inclou molts grups importants científicament, mèdicament i ambientalment, amb aquests ordres principals:
Xanthomonadales, bacils aerobis, la majoria són fitopatògens com espècies de Xanthomonas que afecten els cultius de cítrics, tomàquets, arròs i altres, i Xylella a la vinya. Alguns són patògens oportunistes dels humans.
Chromatiales, són els bacteris porpra de sofre (Chromatium, Thiocapsa), que fan la fotosíntesi anoxigènica a partir de sulfurs o tiosulfat, produint sofre. Tenen membranes internes amb bacterioclorofil·la i carotens. Són presents a les zones anòxiques de llacs i altres hàbitats aquàtics com les zones intermareals.
Methylococcales, com Methylococcus, són un altre gran grup de metilòtrofs, que utilitzen metà com a font d’energia i de C, i que és oxidat a formaldehid, que s’assimila pel cicle de ribulosa monofosfat, en membranes internes en forma de discs perpendiculars a la paret cel·lular.
Thiotricales, són sobretot quimiolitòtrofs, amb formes de cocs agrupats en filaments, que acumulen grànuls de sofre. Beggiatoa viu en aigües que contenen H2S, i l’oxida a sofre, però també és heteròtrof. Thiomargarita namibiensis, trobat en sediments marins, és el bacteri més gran mai trobat, fins a 0,7 mm de diàmetre, i acumula S al periplasma i nitrat en vacuoles, ja que també és nitrificant.
Legionellales, amb Legionella, bacils pleomòrfics aerobis, coneguts patògens causants de pneumònia (legionel·losi) i altres malalties respiratòries. La majoria d’infeccions estan relacionades amb torres de refrigeració mal mantingudes.
Oceanospirillales són un grup divers metabòlicament però tots prefereixen o els cal un alt contingut en sal, com Halomonas, bacils aerobis mòbils.
Pseudomonodales inclou molts bacils o cocobacils mòbils (flagel·lació polar) heteròtrofs aerobis estrictes i oxidasa positius. Pseudomonas és un dels gèneres bacterians més ubics a molts hàbitats terrestres i aquàtics, amb alguns patògens de plantes i altres oportunistes dels humans, i força malbaratadors d’aliments. Alguns (P. syringae) faciliten la nucleació de cristalls de gel donant lloc a la congelació de teixits vegetals o la condensació de núvols o la formació de neu artificial (vegeu meu post). D’altra banda, la seva gran i diversa capacitat catabòlica aeròbica fa que siguin útils per a depuració d’aigües residuals i bioremediació d’hidrocarburs i altres compostos orgànics complexos. Azotobacter són cocs o de forma oval, mòbils, que formen cists de paret gruixuda i força llim extracel·lular, de vida lliure als sòls, amb un paper rellevant al cicle del N com a fixadors de N2. Acinetobacter són també comuns als sòls, on mineralitzen compostos aromàtics, i alguns són patògens oportunistes sobretot als hospitals. Moraxella són semblants, comensals de mucoses d’animals però també alguns patògens.
Aeromonadales, com Aeromonas, bacils anaerobis facultatius, semblants morfològicament als Enterobacterales, són presents en ambients aquosos, i causa freqüent de gastroenteritis i altres infeccions per ingestió d’aigües o menjar contaminat.
Vibrionales, són vibrions o cocobacils anaerobis facultatius mòbils, presents en medis aquosos, entre els quals hi ha força patògens d’humans, com Vibrio cholerae, i d’altres animals, sobretot peixos. Tanmateix també inclou la majoria de bacteris bioluminiscents: Photobacterium, Aliivibrio i molts Vibrio, d’ambients marins, molts simbiòtics de peixos i altres animals. La llum produïda (490 nm, color cian, blau-verd) ho és per cromòfors lux-flavina lligats a luciferasa, amb oxigen i una cascada de reaccions reductores d’àcids grassos.
Pasteurellales , són bacils o pleomòrfics, sense flagels, anaerobis facultatius i oxidasa positius (a diferència dels Enterobacterales), comensals de superfícies mucoses d’aus i mamífers, alguns patogens. Pasteurella són pleomòrfics i patògens zoonòtics. Molts Haemophilus són patògens humans i H. influenzae fou el primer organisme amb genoma seqüenciat, pel grup de Craig Venter el 1995.
Enterobacterales, inclou la majoria dels gramnegatius amb membrana externa més coneguts, alguns d’ells patògens. Destaquen els anomenats enterobacteris, família Enterobacteriaceae, entre els quals hi ha simbionts i patògens, sobretot a l’intestí dels animals. Són anaerobis facultatius, fan fermentació àcido-mixta i altres metabolismes, no tenen citocrom c oxidasa, i la majoria són bacils o cocobacils mòbils amb flagel·lació peritrica. Hi destaquen Escherichia coli, segurament el bacteri més conegut i organisme model del coneixement bioquímic, genètic i molecular. Alguns E. coli són patògens, altres oportunistes, molts comensals, i alguns fins i tot beneficiosos membres de la microbiota intestinal, utilitzats com a probiòtics. També són Enterobacteriaceae: Salmonella, patogen intracel·lular de molts animals per endotoxines, causant als humans de febres tifoides, infeccions de transmissió alimentària i altres patogènies; Shigella, patogen d’humans i altres primats, també amb endotoxines, és dels principals causants de diarrees; Yersinia pestis, cocobacil patogen ben conegut per les epidèmies; Klebsiella és ubic a molts ambients, comensal habitual de mucoses i intestí d’humans; Enterobacter són coliformes fecals termotolerants (creix a 44,5ºC), patògens oportunistes i alguns són útils en productes lactis; Citrobacter poden utilitzar citrat com a única font de C, també són ubics a molts ambients, i majoria no són patògens
Del mateix ordre Enterobacterales però d’altres famílies són: Erwinia, patogen de plantes; Hafnia, comensal del tracte gastrointestinal humà, usat com a ferment làctic, i possible probiòtic; Proteus, patogen oportunista; i finalment, Thorsellia, present a microbiota intestinal del mosquit Anopheles, que podria utilitzar-se modificat genèticament contra el mosquit i així prevenir transmissió de malària.
LLISTAT alfabètic de 147 GÈNERES bacterians, amb els Fílums corresponents (noms abans 2021)
(enllaç clicant al fílum)
Aquest no és un llistat fix i estàtic: si us plau, si noteu a faltar algun altre gènere que considereu important, m’ho dieu i l’incorporaré.
Bibliografia
Bacterial phyla, Wikipedia
Bacterial taxonomy, Wikipedia
Cavalier-Smith T (1993) Kingdom protozoa and its 18 phyla. Microbiol Reviews 57, 953-94
Hug LA et al. (2016) A new view of the tree of life. Nat Microbiol. 1, 16048
Lang JM, Darling AE, Eisen JA (2013) Phylogeny of bacterial and archaeal genomes using conserved genes: Supertrees and supermatrices. PLoS ONE 8(4): e62510
Lengeler JW, Drews G, Schlegel HG (1999) Biology of the Prokaryotes. Blackwell Science.
Madigan M, Bender KS, Buckley DH, Sattley WM, Stahl DA (2017) Brock Biology of Microorganisms, 15th ed. Pearson.
MicrobeWiki: https://microbewiki.kenyon.edu/index.php/MicrobeWiki
NCBI, National Center for Biotechnology Information: https://www.ncbi.nlm.nih.gov
Oren A, Garrity GM (2021) Valid publication of the names of forty-two phyla of prokaryotes. Int J Syst Evol Microbiol 71:5056.
Parte AC (2014) LPSN – list of prokaryotic names with standing in nomenclature. Nucleic Acids Research 42, D1, D613-D616.
SCB, Societat Catalana de Biologia, IEC (2009-210). Els plurals d’alguns mots acabats en –us o en –um. Què cal saber, n. 210.
SCB, Societat Catalana de Biologia, IEC (2009-216). La denominació dels arqueus. Què cal saber, n. 216.
Stackebrandt E, Murray RGE, Trüper HG (1988) Proteobacteria classis nov., a name for the phylogenetic taxon that includes the “Purple bacteria and their relatives”. Int J Syst Bact 38, 321-325
Tortora GJ, Funke BR, Case CL, Weber D, Bair W. (2018) Microbiology: an Introduction. 13th ed. Pearson.
Whitman WB, ed. (2015) Bergey’s manual of systematics of archaea and bacteria. ISBN 9781118960608.
Whittaker RH (1969) New concepts of Kingdoms of organisms. Science 163, 150-160.
Wiley J, Sherwood L, Woolverton CJ (2017) Prescott’s Microbiology, 10th ed. McGraw Hill Education.
Woese CR (1987). Bacterial evolution. Microbiological Reviews 51(2): 221–71
Zheng J, Wittouck S, Salvetti E et al (2020) A taxonomic note of the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostococaceae. Int J Syst Evol Microbiol 004107
Bacteroides, els bacteris gramnegatius més abundants dins nostre
21 març 2019
Click here for the English version: Bacteroides, our most abundant gram-negative bacteria
Actualització d’aquest tema: vegeu els treballs del grup de Yolanda Sanz del IATA-CSIC, com Gómez del Pulgar et al., 2020.
Qui són els Bacteroides?
Bacteroides és el gènere més conegut del grup de bacteris gramnegatius més abundants dins nostre, en concret dins l’intestí. Són fins a 8·1010 per gram de femta, entre un 20 i un 40% del total de la microbiota intestinal. Per extensió, aquest grup que inclou altres gèneres relacionats, es coneixen com a bacteroidals. Són anaerobis estrictes, no esporulats, no mòbils, tenen forma de bacils amb puntes arrodonides (Figura 1), són resistents a les sals biliars, a concentració del 20% de l’intestí prim, i tenen una bona capacitat d’utilització de polisacàrids.

Figura 1. Micrografia electrònica de cèl·lules de Bacteroides sp. D8 (Gerard et al 2007)
Abans que res, cal senyalar que hi han excel.lents revisions de Bacteroides, com la de Wexler (2007), tant dels seus aspectes beneficiosos dins la microbiota intestinal -que aquí comentarem-, com dels aspectes tòxics i altres característiques.
Els bacteroidals viuen exclusivament al tracte gastrointestinal dels animals, i per tant mostren una gran flexibilitat per adaptar-se a les condicions nutritives de l’ambient intestinal. Com a comensals i mutualistes, estableixen associacions a llarg termini amb els hostes i els proporcionen beneficis. L’adaptació d’aquests bacteris inclou el fer modificacions d’aquest ambient, com per exemple força Bacteroides codifiquen per a una citocrom bd oxidasa, que pot reduir les concentracions d’oxigen, amb la qual cosa els és més fàcil créixer com a anaerobis estrictes que són, i de pas, altres bacteris de la microbiota habitual també en surten beneficiats (Wexler, Goodman 2017).
El substrat més usual d’aquests bacteris són els polisacàrids vegetals de la dieta i del mucus de l’hoste (Wexler, Goodman 2017). En degradar i fermentar aquests carbohidrats, apareixen com a producte principal els àcids grassos de cadena curta (AGCC). Precisament un dels principals beneficis dels bacteroidals és que són els que produeixen més propionat al tracte intestinal, i el propionat és un dels AGCC beneficiosos, junt amb l’acetat i el butirat, ja que són font d’energia per als colonòcits i contribueixen al manteniment de les correctes homeòstasis de glucosa i el metabolisme lipídic (Ríos-Covián et al 2017). També treuen cadenes laterals de les sals biliars, facilitant el retorn dels àcids biliars a la circulació hepàtica. D’altra banda, un altre aspecte beneficiós és que exclouen altres possibles patògens ja que colonitzen el tracte intestinal i no deixen establir-se a altres.
Degut al fet que el tracte intestinal dels animals és el principal hàbitat i reservori ambiental dels bacteroidals, es pensa que hi ha hagut una relació evolutiva simbiòtica entre aquests bacteris i els hostes (Troy, Kasper 2010). Com en molts altres casos evolutius, aquest comensalisme mutualístic entre els microorganismes i l’hoste és quasi una simbiosi, on pràcticament cadascun dels organismes no pot viure sense l’altre.
Com a residents habituals de l’intestí, la gran majoria de Bacteroides no són nocius, sinó al contrari, però en condicions de desequilibris metabòlics com la diabetis o en pacients quirúrgics, alguns d’ells són oportunistes i poden ser patògens, i a més, alguns tenen certa resistència a antibiòtics. De fet, B. fragilis, l’espècie més abundant a la microbiota de persones sanes, pot donar en aquests casos infeccions molt greus i és el bacteri anaeròbic patogen més important en humans (Mancuso et al 2005). L’abundància deB. fragilis és evident fins i tot pel fet que els seus bacteriòfags són utilitzats com a traçadors de matèria fecal humana en aigües (Jofre et al 1995).
Quin tipus de bacteris són els Bacteroides?
Tal com detalla l’apartat de Taxonomia del NCBI, el gènere Bacteroides és un bacteri del superfílum Fibrobacter-Chlorobi-Bacteroidetes. Veiem la seva relació filogenètica amb la resta de fílums bacterians a la Figura 2. El fílum Bacteroidetes inclou també Cytophaga, Flavobacter i Sphingobacter, a més de la classe Bacteroidia, que sobretot inclou l’ordre Bacteroidales. Aquest inclou 2 famílies: les Bacteroidaceae i les Prevotellaceae. A banda de Bacteroides, Prevotella és un altre dels gèneres més coneguts, que de fet abans era conegut com B. melaninogenicus. Globalment parlem de bacteroidals per referir-nos a tot l’ordre.

Figura 2. Arbre filogenètic dels diversos grups de bacteris (Bern, Goldberg 2005)
Bacteroides, uns dels predominants a la microbiota intestinal humana
La microbiota intestinal humana, i dels mamífers en general, és molt complexa, però sorprenentment hi han pocs fílums que predominin. En concret, el 98% dels bacteris identificats en humans (Figura 3) són de 4 fílums: 64% Firmicutes, 23% Bacteroidetes, 8% Proteobacteria i 3% Actinobacteria. Per tant, els bacteroidals són uns dels bacteris, i per tant microorganismes, més predominants a la microbiota intestinal. De fet, com que els Firmicutes són un fílum tan gran i divers, que inclou coses tan diferents com els clostridials i els bacteris làctics, es pot considerar que els bacteroidals, com a grup molt més homogeni, són pràcticament els predominants.

Figura 3. Composició bacteriana del còlon humà deduïda dels 16S rRNA obtinguts de 17242 seqüències de mostres fecals (Madigan et al 2012)
Per veure amb més detall quines són les espècies predominants de la microbiota intestinal, molt recentment s’ha fet un estudi metagenòmic i funcional de 737 genomes seqüenciats d’aïllats bacterians de mostres fecals de 20 adults britànics i nordamericans (Forster et al 2019). S’hi han detectat 273 espècies bacterianes, de les quals 105 no s’hi havien trobat abans. Com veiem (Figura 4), entre les 20 espècies dominants n’hi han 8 Bacteroides, més 2 Parabacteroides, o sigui 10, senyalades en verd. Per tant, la meitat de les espècies majoritàries són bacteroidals. Les altres 10 són 6 clostridials (Firmicutes, en blau), 3 són Actinobacteria (en groc) i 1 és Proteobacteria (en taronja).

Figura 4. Espècies majoritàries de la microbiota intestinal humana, detectades a partir de anàlisis metagenòmiques (Forster et al 2019).
Encara que la microbiota és diferent segons les persones, a nivell de soca la microbiota individual és molt estable. En un estudi amb 37 persones sanes (Faith et al 2013) s’han trobat unes 200 soques de 100 espècies diferents, i el 60% de les soques romanen a cada persona en un període de 5 anys. D’aquestes que romanen, les de Bacteroidetes i Actinobacteria són els més estables.
En aquest mateix estudi (Faith et al 2013), s’han comparat les microbiotes de 6 persones d’una mateixa família i s’ha vist que entre les 75 espècies bacterianes més freqüents a tots 6 es troben 18 Bacteroidetes (24%): 11 Bacteroides, 3 Parabacteroides, Alistipes, Barnesiella, Odoribacter i Butyricimonas. La única espècie de les 75 que es troba a totes 6 persones és un Bacteroides: B. vulgatus.
La microbiota que ens acompanya va canviant al llarg de la vida (Figura 5). En el cas de Bacteroides, de fet als nadons n’hi ha relativament pocs. Tanmateix, ja són part normal de microbioma de la placenta, on predominen els Proteobacteria (Aagard et al 2014). Després del part, els bacteroidals van augmentant al llarg dels primers mesos i anys, en anar deixant la llet i amb els canvis de dieta, tal com augmenta la diversitat, fins arribar als adults on Bacteroides són dels més abundants (Gómez-Gallego, Salminen 2016).

Figura 5. Canvis a la microbiota humana al llarg de la vida (Gómez-Gallego, Salminen 2016).
La ingesta de menjar sòlid als infants, entre 4 mesos i 1 any, causa un notable increment de Bacteroidetes (Figura 6). Hi veiem la gran diferència en composició microbiana que hi ha dels 118 dies als 370. Llàstima que en aquest estudi (Koenig et al 2011) no hagin pres més mostres intermèdies, on poc a poc es va passant de farinetes i una mica de cereals, a la ingesta de pèsols i altres llegums, pastanagues, patata, etc. Aquest augment dels Bacteroidetes amb el menjar sòlid segurament està relacionat amb que bacteroidals són especialistes en el trencament de polisacàrids complexes, i alhora aquests impulsen el creixement d’aquests bacteris. Al mateix temps hi ha un clar augment dels nivells d’AGCC, un enriquiment de gens de la microbiota associats amb la utilització de carbohidrats, una major biosíntesi de vitamines, i també en la degradació de xenobiòtics. Per tant, el paper dels Bacteroidetes sembla primordial en l’establiment i manteniment de la microbiota de l’adult. Si bé hi ha diferències entre individus, un cop adults la composició microbiana és força estable al llarg de la vida, però amb certes variacions en funció dels canvis de dieta o d’hàbitat o de medicacions.

Figura 6. Anàlisi metagenòmica de seqüències de DNA extretes de mostres fecals d’infants (Koenig et al 2011).
Bacteroidals als altres mamífers
La microbiota intestinal és present a tots els animals amb sistema digestiu més o menys desenvolupat. A banda dels insectes on se l’ha estudiat força (Engel, Moran 2013), els més estudiats en aquest aspecte lògicament són els mamífers. Se n’ha estudiat la seva composició (Ley et al 2008), en concret a mostres fecals de 106 individus de 60 espècies de 13 tàxons diferents, incloent primats humans i no humans, tant herbívors com carnívors i omnívors. Dels 17 fílums de bacteris trobats, eren un 65% de Firmicutes, un 16% Bacteroidetes, 8% Proteobacteris i 5% d’Actinobacteris, entre altres. Per tant, és evident la rellevància dels bacteroidals, i les proporcions són semblants a les que més amunt hem comentat per a humans. En quant al grup majoritari de Firmicutes, és una llàstima que aquest treball, com força altres, no en distingeixi els diversos grups, sobretot entre lactobacils i clostridials. En aquest treball curiosament s’observa una major presència de Bacteroides als primats i als omnívors en general, i també a alguns herbívors, que als carnívors estudiats (Figura 7). En aquests hi ha molt pocs Bacteroidetes, i en canvi hi ha més gamma-proteobacteris, probablement enterobacteris (Ley et al 2008).
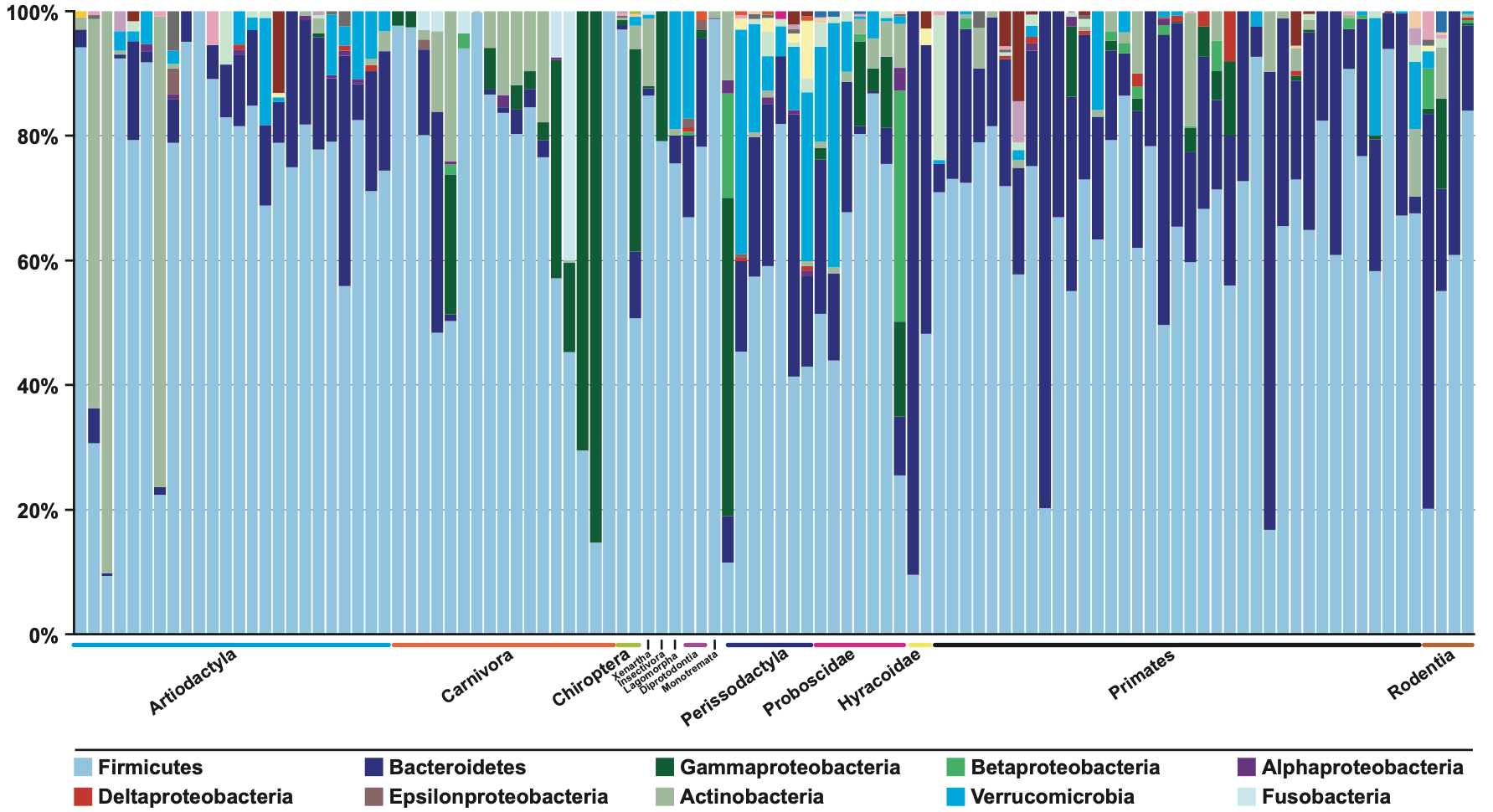
Figura 7. Percentatges de seqüències de mostres fecals de diferents mamífers assignats als principals diferents fílums bacterians (Ley et al 2008)
Diferents bacteroidals són biomarcadors d’estils de vida
En la cerca de tàxons microbians que puguin ser biomarcadors de dietes o d’estils de vida, s’ha vist que en comparar persones de països rics occidentals amb les de països subsaharians, a les primeres el biomarcador més clarament relacionat és el gènere Bacteroides, mentre que als subsaharians ho és Prevotella, una altra del mateix fílum Bacteroidetes. Com veiem, aquests dos gèneres, junt amb alguns clostridials, són els gèneres més abundants.
Si la dieta majoritària a llarg termini és rica en proteïnes i greixos animals, com passa als països occidentals, predomina Bacteroides, i en canvi si la dieta és rica en carbohidrats com als països subsaharians, predomina Prevotella (Gorvitovskaia et al 2016).
Què passa amb Bacteroides en casos de disfuncions ?
La rellevància beneficiosa dels Bacteroides sobre la salut és patent en casos de malalties o disfuncions com les al·lèrgies o l’obesitat (Figura 8), on la diversitat de la microbiota és molt menor, i el nombre de bacteroidals (Bacteroidetes) baixa molt.

Figura 8. Canvis a la microbiota en situacions disfuncionals com al·lèrgies i obesitat. (Gómez-Gallego, Salminen 2016).
Bacteroides contra l’obesitat
Uns experiments molt coneguts de microbiota intestinal en relació amb l’obesitat han estat els realitzats amb ratolins sense microbiota prèvia colonitzats amb microbiota procedent de bessons humans dels quals un era obès i l’altre prim (Ridaura et al 2013), amb el resultat que els ratolins amb microbiota del bessó obès (Ob) esdevenen obesos, mentre que els de microbiota del bessó prim romanen prims (Ln) (Figura 9). A més, en els ratolins prims s’observa una major producció intestinal d’AGCC i una més gran transformació microbiana dels àcids biliars, mentre que als obesos hi ha un major metabolisme d’aminoàcids ramificats.
Com hem comentat a l’apartat anterior, en els ratolins obesos s’observa una reducció del 50% de Bacteroidetes, a banda d’un augment de Firmicutes i de metanògens (Figura 10). Com veiem els arquees metanògens disminueixen l’hidrogen produït donant metà, i el menor nivell d’hidrogen promou la fermentació per part dels Firmicutes, de l’excés de menjar ingerit.

Figura 9. Ratolins obès i prim resultants de la colonització amb microbiotes de bessons humans obès i prim, respectivament (imatge de Kay Chernush / Getty Images).

Figura 10. Diferències en les comunitats microbianes intestinals entre ratolins prims (esquerra) i obesos (dreta) (Madigan et al 2012).
El més sorprenent però d’aquest treball (Ridaura et al 2013) és l’experiment de cohabitació dels dos tipus de ratolins Ob i Ln on s’observa que després de 10 dies de conviure junts els obesos no presenten tant greix corporal (Figura 11), i en estudiar les microbiotes per seqüenciació, es veu que hi hagut una transferència de la microbiota dels ratolins prims als obesos (Figura 12). Com veiem, els principals bacteris transferits són bacteroidals, cosa que reforça la importància d’aquests bacteris que revisem en aquest article.

Figura 11. Adipositat (% greix corporal) de ratolins obesos (Ob) i prims (Ln), i els mateixos després de 10 dies de cohabitatge a la mateixa gàbia (Obchi Lnch) (Ridaura et al 2013).

Figura 12. Demostració de la transferència de bacteroidals (7 espècies: 5 Bacteroides, 1 Parabacteroides i 1 Alistipes) de la microbiota intestinal de ratolins prims (Lnch) als obesos (Obch) després de 10 dies de cohabitatge a la mateixa gàbia. Cada columna correspon a un ratolí (Ridaura et al 2013).
Bacteroides contra el colesterol
Fa molts anys que se sap que la microbiota intestinal és capaç de convertir el colesterol en la seva forma saturada, el coprostanol (Figura 13), i en el cas d’altres mamífers s’havien trobat alguns clostridials (Eubacterium) com a responsables, però en els humans no ens coneixia quins microorganismes podien fer-ho. Recentment Gérard et al (2007) han aïllat una soca de femta humana que ho fa i l’han pogut identificar com a Bacteroides, probablement una espècie propera a B.vulgatus.

Figura 13. Fórmules del colesterol i del coprostanol (Gerard et al 2007)
Els glicans (polisacàrids), importants per al mutualisme entre Bacteroides i l’hoste humà
La majoria de les macromolècules no digerides que arriben al còlon són glicans (terme pràcticament sinònim de polisacàrids), que són una part molt important de la fibra. L’únic glicà que és quasi tot digerit prèviament a l’intestí prim és el midó. El consorci de microorganismes que habiten el còlon produeix un repertori enzimàtic enorme amb la capacitat de degradar un ventall de polisacàrids complexos que l’hoste no pot processar. Per això la microbiota intestinal es refereix sovint com un òrgan metabòlic.
D’altra banda, els abundants microbis comensals de la microbiota intestinal han d’haver resistit les condicions inhòspites dels trams previs al còlon i per establir-se al còlon ho han de fer de manera que no afectin l’hoste. Per això, enlloc d’interactuar amb les cèl·lules epitelials de l’intestí, romanen a la capa de mucus externa a la superfície epitelial. Al mateix temps, aquest mucus protegeix els microbis residents dels atacs d’altres bacteris i dels bacteriòfags, i els és un substrat de nutrients. S’ha comprovat que la capacitat de subsistir en aquest ecosistema està molt relacionada amb la utilització i producció de glicans per part dels bacteris residents (Comstock 2009).
Doncs justament aquesta capacitat de relació amb els glicans és una característica important dels bacteroidals, que tal com hem vist, són els microorganismes més abundants a l’intestí, juntament amb els Firmicutes. Efectivament, els Bacteroides tenen una extensa maquinària enzimàtica per utilitzar els polisacàrids complexos presents al còlon, i els utilitzen com a font de carboni i d’energia. Aquesta gran capacitat s’ha comprovat en seqüenciar el genoma de B. thetaiotaomicron (Xu et al 2003) i veure que conté més de 80 loci d’utilització de polisacàrids que codifiquen per a proteïnes relacionades amb la detecció, importació i degradació de glicans específics del còlon.
Com veiem (Figura 14), aquests bacteroidals utilitzen tant els glicans de la dieta de l’hoste com els produïts per l’epiteli intestinal, els metabolitzen, i produeixen per un costat els beneficiosos AGCC, i d’altra banda, sintetitzen glicans que acumulen en forma d’exopolisacàrid (EPS) contribuint a formar biofilms, i en càpsules que donen senyals immunomoduladores a l’hoste (Comstock 2009). Tot plegat, es constata la rellevància dels glicans en les relacions de mutualisme entre Bacteroides i l’hoste humà.
Figura 14. Utilització i producció dels glicans (polisacàrids) per Bacteroides. IM (inner membrane): membrana citoplasmàtica; OM (outer membrane): part externa de paret cel·lular dels gramnegatius; EPS: exopolisacàrid de capes mucoses no unit covalentment, a diferència del polisacàrid capsular (Comstock 2009)
A més dels glicans produïts per l’hoste, alguns Bacteroides també poden utilitzar els que produeixen altres microorganismes de la microbiota, com s’ha demostrat per a B. fragilis, l’espècie més freqüent a la superfície de la mucosa intestinal, que pot metabolitzar els exopolisacàrids produïts per bifidobacteris (Ríos-Covian et al 2016). La producció d’EPS pels bifidobacteris està estimulada per la bilis. Aquesta capacitat de B. fragilis d’utilitzar el EPS dels bifidobacteris els dóna més capacitat de supervivència quan els nutrients són escassos. Al mateix temps, la degradació dels EPS pot afectar la viabilitat dels bifidobacteris, i per tant, aquests bacteroidals tindrien un paper regulador de la microbiota intestinal en general.
Alguns glicans produïts pels bacteroidals tenen un efecte beneficiós en el sistema immunològic de l’hoste. En concret, s’ha vist que el polisacàrid A (PSA) produït per B. fragilis és capaç d’activar la resposta immune dependent de cèl·lules T, que influeix en el desenvolupament i l’homeòstasi del sistema immune (Troy, Kasper 2010). En efecte, la colonització de ratolins sense microbiota (germ-free) amb B .fragilis és suficient per corregir el desequilibri previ de cèl·lules Th1 i Th2 (T helper) (Figura 15). A més, el PSA pot protegir de les colitis, com les produïdes per Helicobacter, mitjançant la repressió de citoquines proinflamatòries associades amb un altre tipus de cèl·lules T, les Th17, i altres mecanismes (Mazmanian et al 2008).

Figura 15. Impacte del polisacàrid A (PSA) de Bacteroides fragilis en el desenvolupament dels sistema immunològic mitjançant la recuperació de l’equilibri de cèl·lules Th1/Th2 (Troy, Kasper 2010).
La dieta pot fer que els Bacteroides contribueixin a un bon equilibri metabòlic
En relació al que he comentat dels glicans com els EPS, s’ha vist que si al medi hi ha poc N orgànic i un carboni fàcilment fermentable com la glucosa, els bacteroidals produeixen més lactat i menys propionat, i en canvi amb més nitrogen orgànic (extracte de llevat) i els polisacàrids, aquests bacteris produeixen més propionat (Ríos-Covián et al 2017). Quan els EPS són presents, com a carbohidrats més complexos i lents de fermentar, el carboni dels aminoàcids pot ser incorporat a nivell de piruvat, i aleshores la via cap a succinat i propionat està potenciada i es manté millor l’equilibri redox. Com que una major producció de propionat és beneficiosa per a l’hoste, aquests autors conclouen que en casos de disfuncions metabòliques de l’hoste, un disseny d’una bona dieta (carbohidrats complexos amb nitrogen orgànic) contribuiria a modificar l’activitat metabòlica de Bacteroides, i aquests a més d’interactuar amb els altres bacteris beneficiosos, ajudarien a promoure efectes saludables a l’hoste.
Bacteroides com a probiòtics ?
La EFSA (Autoritat Europea per a la Seguretat Alimentària) no ha acceptat pràcticament cap al·legació d’efectes positius dels probiòtics sobre la salut a causa dels requeriments restrictius dels estudis amb humans. El mecanisme d’acció dels probiòtics és soca-dependent i sovint no es coneix prou bé. A més, podria ser que els bacteris incorporats no produïssin canvis mesurables suficients en individus sans com per obtenir una al·legació d’efecte sobre la salut. Calen més estudis a nivell genètic, perfil de resistència a antibiòtics i criteris de selecció del probiòtic.
Els probiòtics tradicionals són sobretot Lactobacillus, Bifidobacterium, però també algunes soques d’altres bacteris làctics, i de Bacillus, d’E. coli i de Saccharomyces. A banda d’aquests, recentment s’estan introduint els anomenats probiòtics de nova generació, gràcies sobretot a les noves tècniques de cultius i de seqüenciació. Entre aquests nous possibles probiòtics destaquen el verrucomicrobial Akkermansia muciniphila, alguns clostridials (vegeu el meu post) com Faecalibacterium prausnitzii, principal productor de butirat, però naturalment també els bacteroidals. Aquests tenen a més un clar avantatge sobre els clostridials i altres Firmicutes, que són molt més estables al tracte intestinal al llarg de la vida de la persona (Faith et al 2013).
Com hem vist, essent uns dels microorganismes més abundants a la nostra microbiota intestinal, Bacteroides té generalment uns clars beneficis per a l’hoste, dels quals ja hem vist alguns, com l’obesitat, o el colesterol. Els transplantaments de microbiota fecal per a casos de diarrees associades amb infeccions de Clostridium difficile estan tenint èxit (Van Nood et al 2013) i per tant s’està veient la possibilitat d’utilitzar alguna soca concreta o diverses, i amb això els Bacteroides són uns clars candidats per la seva abundància en les mostres de microbiota fecal.
A més dels esmentats, altres beneficis dels Bacteroides són els relacionats amb el sistema immune, a nivell de citoquines i de cèl·lules T i desenvolupament d’anticossos, per tal de tractar colitis intestinals, disfuncions immunes, desordres del metabolisme i fins i tot prevenció del càncer (Tan et al 2019).
A banda dels beneficis demostrats per a l’hoste, per ser considerada probiòtica una soca bacteriana ha de tenir un estatus de seguretat sense ambigüitats. En el cas de Bacteroides, recentment s’ha estudiat una soca (DSM 23964) de B. xylanisolvens aïllada de femta d’humans sans que pot ser probiòtic i de la qual s’ha demostrat que no té determinants de virulència que s’han trobat en alguns Bacteroides oportunistes, com l’absència d’enterotoxina bft i d’activitats enzimàtiques biodegradadores de matriu extracel·lular i de PSA. Tampoc té resistència a força antibiòtics -tanmateix sí que és resistent a alguns- i no s’hi han detectat plasmidis, amb la qual cosa fa molt improbable la transferència de possibles resistències. Per tant, aquesta soca sembla ben segura (Ulsemer et al 2012a). També s’ha vist que no s’adhereix a les parets de l’intestí, però resisteix l’acció dels enzims gàstrics i el baix pH. A més, tal com indica el nom de l’espècie, degrada xilà i altres pectines, la qual cosa lliga amb l’efecte positiu que tenen els prebiòtics, o sigui aquests compostos, en aquest cas heteropolisacàrids, que són beneficiosos per a la microbiota intestinal.
Altres característiques bàsiques de probiòtic trobades en aquesta soca són la producció d’AGCC i les propietats immunomoduladores. Aquestes propietats i la seguretat i bona tolerància d’aquesta soca de B. xylanisolvens s’han comprovat incorporant-la, inactivada per calor, en una llet fermentada que en assajos ha estat ingerida per humans sans (Ulsemer et al 2012b). La seva seguretat també s’ha confirmat en estudis de toxicitat en ratolins, on altes dosis de la soca no han donat efectes tòxics ni mutagènics, ni danys hematològics ni histopatològics (Ulsemer et al 2012c).
En base a aquests estudis, l’Autoritat Europea de Seguretat Alimentària ha donat el vist-i-plau a la utilització de les llets fermentades amb B. xylanisolvens DSM 23964 pasteuritzat com a nou aliment (EFSA 2015). Tanmateix, no hi ha sol·licitud de considerar-la com a probiòtic, sobretot pel fet que els bacteris no són viables ja que s’ha pasteuritzat el producte, i per definició, els probiòtics han de ser microorganismes vius.
Perspectives
Hem vist la rellevància de Bacteroides com un dels components principals de la microbiota intestinal humana i de mamífers en general. A més del seu paper fonamental dins l’intestí, i de les possibilitats de la seva utilització com a probiòtic, cal afegir que és un model ideal per a l’estudi dels bacteris intestinals, a més de la seva abundància, perquè és relativament fàcil de cultivar, i té possibilitats de ser manipulat genèticament (Wexler, Goodman 2017). Per tant, cal aprofundir en el coneixement dels bacteroidals, i en particular de com metabolitzen els nutrients o el mucus de l’hoste, o com responen als canvis de dieta de l’hoste i altres pertorbacions, o com interactuen amb els altres microorganismes presents al digestiu. Una millor comprensió de tots aquests mecanismes afavorirà el disseny de terapèutiques dirigides per modificar la microbiota de pacients que pateixen diverses malalties, infeccions i desordres metabòlics lligats a la microbiota intestinal (Wexler, Goodman 2017).
Bibliografia
Aagaard K(2014) The placenta harbors a unique microbiome. Sci Transl Med6, 237ra65
Bern M, Goldberg D (2005) Automatic selection of representative proteins for bacterial phylogeny. BMC Evolut Biol 5:34
Comstock LE (2009) Importance of glycans to the host – Bacteroidesmutualism in the mammalian intestine. Cell Host & Microbe 5, 522-526
EFSA, European Food Safety Authority (2015) Scientific opinion on the safety of “heat-treated milk products fermented with Bacteroides xylanisolvensDSM 23964″ as a novel food. EFSA J 13(1):3956
Engel P, Moran NA (2013) The gut microbiota of insects – diversity in structure and function. FEMS Microbiol Rev 37, 699-735
Faith JJ et al (2013) The long-term stability of the human gut microbiota. Science 341, 1237439
Forster et al (2019) A human gut bacterial genome and culture collection for improved metagenomic analyses. Nature Biotechnol 37, 186-192
Gérard P et al (2007) Bacteroides sp. strain D8, the first cholesterol-reducing bacterium isolated from human feces. Appl Env Microbiol 73, 5742-5749
Gómez-Gallego C, Salminen S (2016) Novel probiotics and prebiotics: how can they help in human gut microbiota dysbiosis ? Appl Food Biotechnol 3, 72-81
Gómez del Pulgar EM, Bénitez-Páez A, Sanz Y (2020) Safety assessment of Bacteroides uniformis CECT 7771, a symbiont of the gut microbiota in infants. Nutrients 12, 551
Gorvitovskaia A et al (2016) Interpreting Prevotella and Bacteroides as biomarkers of diet and lifestyle. Microbiome 4:15, 1-12
Jofre J et al (1995) Potential usefulness of bacteriophages that infect Bacteroides fragilis as model organisms for monitoring virus removal in drinking water treatment plants. Appl Environ Microbiol 61, 3227-3231
Koenig JE et al (2011) Succession of microbial consortia in the developing infant gut microbiome. PNAS 108, 4578-4585
Ley RE et al (2008) Evolution of mammals and their gut microbes. Science 320, 1647-1651
Madigan MT, Martinko JM, Stahl DA, Clark DP (2012) Brock Biology of Microorganisms. 13th Ed. Pearson
Mancuso G et al (2005) Bacteroides fragilis– derived lipopolysaccharide produces cell activation and lethal toxicity via Toll-like receptor 4. Infect Immunity 73, 5620-5627
Mazmanian et al (2008) A microbial symbiosis factor prevents intestinal infammatory disease. Nature 453, 620-625
Ridaura VK et al (2013)Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 341, 1241214
Ríos-Covian et al (2016) Bacteroides fragilismetabolises exopolysaccharides produced by bifidobacteria. BMC Microbiol 16, 150
Ríos-Covian et al (2017) Shaping the metabolism of intestinal Bacteroidespopulation through diet to improve human health. Front Microbiol 8, 376
Tan H et al (2019) Investigations of Bacteroides spp., towards next-generation probiotics. Food Res Internat 116, 637-644
Troy EB, Kasper DL (2010) Beneficial effects of Bacteroides fragilis polysaccharides on the immune system. Front Biosci 1, 15:25-34.
Ulsemer P et al (2012)a Preliminary safety evaluation of a new Bacteroides xylanisolvens isolate. Appl Env Microbiol 78, 528-535
Ulsemer P et al (2012)b Safety and tolerance of Bacteroides xylanisolvensDSM 23964 in healthy adults. Benef Microb 3, 99-111
Ulsemer P et al (2012)c Safety assesment of the commensal strain Bacteroides xylanisolvensDSM 23964. Regul Toxicol Pharmacol 62, 336-346
Van Nood E (2013) Duodenal infusion of donor feces for recurrent Clostridium difficile. New Eng J Medicine 368, 407-415
Wexler HA (2007) Bacteroides: the Good, the Bad, and the Nitty-Gritty. Clin Microbiol Rev 20, 593-621
Wexler AG, Goodman AL (2017) An insider’s perspective: Bacteroides as a window into the microbiome. Nat Microbiol 2, 17026
Wikipedia contributors. Bacteroides [Internet]. Wikipedia, The Free Encyclopedia, 2019 March 19
Xu J et al (2003) A genomic view of the human – Bacteroides thetaiotaomicronsymbiosis. Science 299, 2074-2076
Bacillus com a probiòtics
Click here for the English version: Bacillus as probiotics
4 d’agost 2017
Els probiòtics
Els probiòtics són microorganismes vius que, en ingerir-los en quantitats adequades, poden tenir algun efecte positiu sobre la salut dels hostes (FAO/WHO 2006; World Gastroenterology Organisation 2011; Fontana et al. 2013). Els hostes poden ser els humans però també altres animals. Els bacteris làctics, sobretot del gènere Lactobacillus, i els bifidobacteris, ambdós considerats com a GRAS (Generally recognized as safe, generalment reconeguts com a segurs), són els més utilitzats com a probiòtics, però altres bacteris i alguns llevats també poden ser útils. A banda de poder ser administrats com a medicaments, els probiòtics es consumeixen normalment des de fa mil·lennis com una part dels aliments fermentats, com passa amb el iogurt i altres productes làctics (vegeu el meu article “Formatge europeu de fa 7400 anys ….” 26 desembre 2012). Com a medicaments, els probiòtics generalment són venuts sense recepta, de venda lliure a les farmàcies (OTC en anglès, over-the-counter).
Ja he comentat en altres articles d’aquest blog la rellevància dels probiòtics (“Un nou probiòtic activa la microbiota contra el càncer de fetge” 13 juliol 2016), així com de la microbiota que conviu amb el nostre cos (“Bacteris controlant el que mengem” 8 set 2014 ; “Bacteris de la llet materna” 26 gener 2013) i dels altres animals (“Microbiota de la pell humana … i del gos de casa” 17 novembre 2015; “El panda gegant i la seva microbiota…” 26 agost 2015).
A banda dels bacteris làctics i els bifidobacteris, altres microorganismes que també s’utilitzen en certa mesura com a probiòtics són el llevat Saccharomyces cerevisiae, algunes soques d’Escherichia coli, i alguns Bacillus, com ara veurem. També comencen a utilitzar-se alguns clostridials, en relació al que vaig comentar en un article anterior d’aquest mateix blog pel març 2015 (“Tenim clostridis bons al budell….”).
Els Bacillus
De fet, els Bacillus i els clostridials tenen en comú la capacitat de formar endòspores. I tots dos grups són grampositius, dins del fílum taxonòmic Firmicutes (Figura 1), que inclou també els bacteris làctics. Tanmateix, els bacil·lals (Bacillus i altres semblants, però també estafilococs i Listeria) són evolutivament més a prop dels lactobacil·lals (els bacteris làctics) que dels clostridials. La principal diferència fisiològica entre Clostridium i Bacillus és que els primers són anaerobis estrictes i Bacillus són aerobis o facultatius.

Figura 1. Esquema d’arbre filogenètic dels bacteris grampositius (Firmicutes i Actinobacteris). Elaboració pròpia.
Les endòspores bacterianes (Figura 2) són les estructures biològiques més resistents, ja que sobreviuen als ambients inhòspits extrems, com radiacions UV i gamma, dessecació, lisozim, altes temperatures (són la referència per als càlculs d’esterilització tèrmica), falta de nutrients i desinfectants químics. Es troben al terra i a l’aigua, on poden sobreviure durant períodes de temps molt llargs.

Figura 2. Endòspores (les parts blanques) de Bacillus subtilis en formació (Imatge de Simon Cutting).
Bacillus als aliments fermentats, sobretot asiàtics
Diversos Bacillus estan implicats clàssicament en els processos de fermentació d’aliments, sobretot per la seva capacitat de producció de proteases, amb la qual cosa durant les fermentacions contribueixen a l’enriquiment nutritiu amb els aminoàcids resultants de la proteòlisi enzimàtica.
Uns d’aquests aliments són els fideus de farina d’arròs fermentada, típics de Tailàndia i Birmània. S’ha vist que en aquesta fermentació intervé una varietat de microorganismes, amb bacteris làctics, llevats i altres fongs, però també bacteris aerobis entre els que hi ha B. subtilis. S’ha trobat que l’activitat proteolítica d’aquests digereix i elimina substrats proteics de l’arròs que són al·lèrgens, com l’azocaseïna, i per tant tenen una activitat beneficiosa per a la salut dels consumidors (Phromraksa et al. 2009).
Tanmateix, l’aliment fermentat amb Bacillus més conegut és la soja fermentada alcalina. Com sabeu, la soja (Glycine max) o faves de soja, són un dels vegetals nutritius més consumits històricament, sobretot als països asiàtics. Se n’obté “llet” de soja, farina de soja, oli de soja, concentrat de soja, iogurt de soja, tofu (llet de soja quallada), i productes fermentats com la salsa de soja, el tempeh, el miso i altres. La majoria d’aquests fermentats es fan amb el fong Rhizopus, afavorint el seu creixement per acidificació o inoculant-lo directament. En canvi, si no s’acidifica i les faves de soja es deixen fermentar només amb aigua, els microbis naturals predominants que ho fermenten són Bacillus, i d’aquesta manera s’obté, entre altres, el “chongkukjang” coreà, el “kinema” de la Índia, el “thua nao” del nord de Taïlàndia, el “douchi” xinès, el “chine pepoke” birmà, i el més conegut, el “natto” japonès (Figura 3). La fermentació espontània amb els Bacillus dona amoni com a subproducte, i per això és alcalina, la qual cosa dóna una olor no gaire bona a molts d’aquests productes, però el natto s’elabora amb un cultiu seleccionat de B. subtilis que hi dóna un olor més suau i agradable (Chukeatirote 2015).
Aquests aliments són bons del punt de vista nutritiu ja que contenen proteïnes, fibra, vitamines, i tot d’origen vegetal o microbià. A més, la publicitat del natto comercial emfatitza, a banda de què és elaborat artesanalment i es ven fresc (no congelat), les seves qualitats probiòtiques, dient que els B. subtilis (Figura 4) que conté promouen la salut gastrointestinal, immunològica, cardiovascular i dels ossos (www.nyrture.com). Diuen que el sabor i la textura del natto són exquisits. Es menja amb arròs o amb altres ingredients i salses, i també dins el maki sushi. Caldrà provar-lo !

Figura 3. El “natto”, faves de soja fermentades amb B. subtilis, esmorzar amb arròs, típic japonès (Pinterest.com)

Figura 4. Micrografia electrònica colorejada de Bacillus subtilis (Nyrture.com)
Bacillus com a probiòtics
Justament les endòspores són el principal avantatge dels Bacillus per ser utilitzats com a probiòtics, gràcies a la seva estabilitat tèrmica i per poder sobreviure les condicions gàstriques (Cutting 2011). Si bé Clostridium també té aquest avantatge, la seva condició d’anaerobi estricte en fa més complexa la seva manipulació, a banda del “mal nom” d’aquest gènere degut a algunes conegudes espècies tòxiques d’aquest gènere.
A diferència d’altres probiòtics com Lactobacillus o Bifidobacterium, les endòspores de Bacillus poden ser emmagatzemades indefinidament sense aigua. Els productes comercials s’administren en dosis d’unes 10^9 espores per gram o per ml.
Cada cop hi ha més productes comercials de probiòtics que contenen Bacillus, tant per a consum humà (Taula 1) com per a ús veterinari (Taula 2). A més a més, també hi ha uns 5 productes específics per a aqüicultura amb diversos Bacillus, i a més sovint les granges de gambes utilitzen els de consum humà (Cutting 2011).
Per a ús en l’aqüicultura s’han obtingut productes probiòtics de barreges de Bacillus (B. thuringiensis, B. megaterium, B. polymixa, B. licheniformis i B. subtilis) aïllant-los de l’intestí de la gamba Penaeus monodon infectada de vibriosis. S’han seleccionat en base a biodegradació de nutrients i a la capacitat inhibitòria del patogen Vibrio harveyi (Vaseeharan & Ramasamy 2003) Són preparats en liòfil o microencapsulades en alginat sòdic, i s’ha comprovat que milloren significativament el creixement i la supervivència de les gambes (Nimrat et al. 2012).
Com veiem per als productes de consum humà, quasi la meitat de les marques (10 de 25) són elaborades al Vietnam. En aquest país l’ús de Bacillus probiòtics està més desenvolupat que en qualsevol altre, però els motius no estan clars. Curiosament allà, com en altres països del sud est asiàtic, no hi ha el concepte de suplements dietètics i els probiòtics com Bacillus només són venuts com a medicaments aprovats pel Ministeri de Salut. Es prescriuen per a la infecció per rotavirus (diarrea infantil) o la estimulació immunològica enfront enverinaments, o són molt freqüentment utilitzats com a teràpia contra infeccions entèriques. Tanmateix, no està clar que s’hagin fet proves clíniques i són productes fàcils de comprar (Cutting 2011).
Taula 1. Productes comercials de probiòtics amb Bacillus, per a consum humà (modificat de Cutting 2011).
| Producte | País del fabricant | Espècies de Bacillus |
| Bactisubtil ® | França | B. cereus |
| Bibactyl ® | Vietnam | B. subtilis |
| Bidisubtilis ® | Vietnam | B. cereus |
| Bio-Acimin ® | Vietnam | B. cereus i 2 altres |
| Biobaby ® | Vietnam | B. subtilis i 2 altres |
| Bio-Kult ® | Regne Unit | B. subtilis i 13 altres |
| Biosporin ® | Ucraïna | B. subtilis + B. licheniformis |
| Biosubtyl ® | Vietnam | B. cereus |
| Biosubtyl DL ® | Vietnam | B. subtilis i 1 altre |
| Biosubtyl I i II ® | Vietnam | B. pumilus |
| Biovicerin ® | Brasil | B. cereus |
| Bispan ® | Corea Sud | B. polyfermenticus |
| Domuvar ® | Itàlia | B. clausii |
| Enterogermina ® | Itàlia | B. clausii |
| Flora-Balance ® | Estats Units | B. laterosporus * |
| Ildong Biovita ® | Vietnam | B. subtilis i 2 altres |
| Lactipan Plus ® | Itàlia | B. subtilis * |
| Lactospore ® | Estats Units | B. coagulans * |
| Medilac-Vita ® | Xina | B. subtilis |
| Nature’s First Food ® | Estats Units | 42 soques, incloent 4 B. |
| Neolactoflorene ® | Itàlia | B. coagulans * i 2 altres |
| Pastylbio ® | Vietnam | B. subtilis |
| Primal Defense ® | Estats Units | B. subtilis |
| Subtyl ® | Vietnam | B. cereus |
| Sustenex ® | Estats Units | B. coagulans |
* Alguns etiquetats com Lactobacillus o altres bacteris porten realment Bacillus
Taula 2. Productes comercials de probiòtics amb Bacillus, per a ús veterinari (modificat de Cutting 2011).
| Producte | Animal | País del fabricant | Espècies de Bacillus |
| AlCare ® | Porcs | Austràlia | B. licheniformis |
| BioGrow ® | Pollastres, vedells, porcs | Regne Unit | B. licheniformis i B. subtilis |
| BioPlus 2B ® | Porcs, pollastres, dindis | Dinamarca | B. licheniformis i B. subtilis |
| Esporafeed Plus ® | Porcs | Espanya | B. cereus |
| Lactopure ® | Pollastres, vedells, porcs | Índia | B. coagulans * |
| Neoferm BS 10 ® | Pollastres, vedells, porcs | França | B. clausii |
| Toyocerin ® | Vedells, pollastres, conills i porcs | Japó | B. cereus |
Les espècies de Bacillus que veiem en aquestes Taules són les que realment s’hi troben, un cop feta la identificació, ja que molts d’aquests productes estan mal etiquetats com a Bacillus subtilis o fins i tot com a Lactobacillus (Green et al. 1999; Hoa et al 2000). Aquests errors en l’etiquetatge poden ser preocupants per al consumidor, i sobretot per qüestions de seguretat, ja que alguns dels trobats són Bacillus cereus, que s’ha vist que pot ser causa d’infeccions gastrointestinals ja que força soques produeixen enterotoxines (Granum & Lund 1997; Hong et al. 2005)
Els possibles Bacillus probiòtics han estat aïllats de diversos orígens. Per exemple recentment se n’han aïllat alguns B. subtilis de l’esmentat chongkukjang coreà, que tenen bones característiques de resistència a les condicions del tracte gastrointestinal (GI) i activitat antimicrobiana contra Listeria, Staphylococcus, Escherichia i fins i tot contra B. cereus (Lee et al 2017).
Un d’aquests productes farmacèutics més coneguts és l’Enterogermina (Figura 5), amb espores de B. subtilis, que és recomanat per al tractament de desordres intestinals associats a alteracions de la microbiota (Mazza 1994).

Figura 5. Enterogermina amb espores de Bacillus subtilis (Cutting 2011)
Bacillus al tracte gastrointestinal: hi són ? hi poden sobreviure ?
S’ha discutit si les espores administrades poden germinar al tracte GI. Treballant amb ratolins, Casula & Cutting (2002) han utilitzat B. subtilis modificats, amb un gen quimèric ftsH-lacZ, que s’expressa només en cèl·lules vegetatives, amb el que es poden detectar per RT-PCR fins a només 100 bacteris. D’aquesta manera han vist que les espores germinen en nombres significatius al jejú i a l’ili. O sigui, que les espores podrien colonitzar l’intestí prim, encara que transitòriament.
De manera similar, Duc et al. (2004) han conclòs que les espores de B. subtilis poden germinar al budell perquè després del tractament oral dels ratolins, se n’excreten més espores a la femta que les ingerides, senyal que han pogut proliferar. També han detectat, mitjançant RT-PCR, mRNA dels bacils vegetatius després de l’administració de les espores, i a més a més, s’ha observat que el ratolí genera resposta amb IgG contra cèl·lules vegetatives del bacteri. O sigui, que les espores no serien passavolants transitoris, sinó que germinarien passant a cèl·lules vegetatives, les quals tindrien una interacció activa amb les cèl·lules hoste o la microbiota, augmentant-ne l’efecte probiòtic.
Amb tot això, potser caldria considerar a molts Bacillus no com a al·lòctons al tracte GI, sinó com a bacteris amb un cicle de vida bimodal de creixement i esporulació, tant al medi ambient com dins el tracte GI de molts animals (Hong et al. 2005).
En quant a la presència normal de Bacillus a l’intestí, quan s’estudien els diferents microorganismes habitants del digestiu humà per anàlisi metagenòmic del DNA de la microbiota, el gènere Bacillus no apareix (Xiao et al. 2015). Com veiem (Figura 6), els més habituals són Bacteroides i Clostridium, seguits de diversos enterobacteris i altres, inclosos els bifidobacteris.

Figura 6. Els 20 gèneres bacterians més abundants a l’intestí d’humans (dreta) i ratolins (esquerra) (Xiao et al. 2015).
Malgrat això, s’han aïllat diverses espècies de Bacillus al tracte GI de pollastres, tractant mostres fecals amb calor i etanol per seleccionar només les espores, seguit d’incubació aeròbica (Barbosa et al. 2005). I més en concret, la presència de B. subtilis a la microbiota d’humans s’ha confirmat mitjançant aïllament selectiu en biòpsies d’ili i també de mostres fecals (Hong et al. 2009). Aquestes soques de B. subtilis presentaven gran diversitat i tenien capacitat de formar biofilms, esporular anaeròbiament i secretar antimicrobians, amb la qual cosa es confirma l’adaptació d’aquests bacteris a l’intestí, i per tant poden ser considerats comensals intestinals, i no solament bacteris del sòl.
Seguretat dels Bacillus probiòtics
El consum oral de quantitats importants de microorganismes viables que no són molt usuals al tracte GI posa sobre la taula dubtes addicionals sobre la seguretat. Això encara més en l’ús d’espècies que no tenen una història d’utilització segura en aliments, com és el cas dels bacteris esporulats. Fins i tot els habitants normals de l’intestí poden actuar a vegades com a patògens oportunistes (Sanders et al. 2003).
Amb l’excepció de B. anthracis i B. cereus, les diverses espècies de Bacillus generalment no es consideren patogèniques. Per suposat, les espores de Bacillus són consumides de forma usual sense adonar-se’n amb els aliments i en alguns fermentats. Encara que els Bacillus són reconeguts com a GRAS per a la producció d’enzims, fins ara la FDA no ha garantit l’estatus de GRAS per a cap esporulat amb aplicació com a probiòtic, ni Bacillus ni Clostridium. Mentre que Lactobacillus i Bifidobacterium han estat subjecte de nombroses i rigoroses proves de no toxicitat crònica i aguda, i un munt d’experts han revisat dades i han conclòs que són segurs com a probiòtics, no hi han dades de toxicitat publicades sobre Bacillus en relació al seu ús com a probiòtics. En fer un repàs al Medline d’articles on surti el terme “probiotic” limitant-se a estudis clínics, de 123 referències no hi ha cap on surti Bacillus (Sanders et al. 2003).
En canvi, hi ha alguns estudis clínics on soques de Bacillus han estat detectades com a toxigèniques. Tot això explica que alguns productors de Bacillus probiòtics es refereixen a ells amb l’enganyós nom de Lactobacillus sporogenes, espècie inexistent, com es pot comprovar al NCBI (https://www.ncbi.nlm.nih.gov/taxonomy/?term=lactobacillus+sporogenes).
Finalment, cal recordar l’informe conjunt sobre probiòtics de la FAO (Organització de les Nacions Unides per a l’Alimentació i l’Agricultura) i la OMS (Organització Mundial de la Salut) (FAO/WHO 2006), que suggereix un conjunt de directrius per tal que un producte sigui utilitzat com a probiòtic, tant en forma única com en forma de nou suplement alimentari. Aquestes recomanacions són:
- Que el microorganisme estigui ben caracteritzat a nivell d’espècie, utilitzant mètodes fenotípics i genotípics (ex. 16S rRNA).
- Que la soca en qüestió estigui dipositada en alguna col·lecció de cultius reconeguda internacionalment.
- Avaluació de la soca in vitro per determinar-ne l’absència de factors de virulència: que no sigui citotòxica ni envaeixi cèl·lules epitelials, i que no produeixi enterotoxines o hemolisines o lecitinases.
- Determinació de la seva activitat antimicrobiana, i el perfil de resistència, incloent l’absència de gens de resistència i la incapacitat per transferir factors de resistència.
- Avaluació preclínica de la seva seguretat en models animals.
- Confirmació en animals demostrant-ne la seva eficàcia.
- Avaluació en humans (Fase I) de la seva seguretat.
- Avaluació en humans (Fase II) de la seva eficàcia (si fa l’efecte esperat) i eficiència (amb el mínim de recursos i el mínim temps).
- Etiquetatge correcte del producte, incloent gènere i espècie, dosi precisa i condicions de conservació.

Conclusions
La utilització de Bacillus com a probiòtics, sobretot en forma de suplements dietètics, està augmentant molt ràpidament. Cada cop més estudis científics demostren els seus beneficis, com estimulació immune, activitats antimicrobianes i competència exclusiva. El seu principal avantatge és que poden ser produïts fàcilment i que el producte final, les espores, és molt estable, amb la qual cosa poden ser incorporats fàcilment al menjar quotidià. A més, hi ha estudis que suggereixen que aquests bacteris poden multiplicar-se al tracte GI i poden ser considerats com a residents temporals (Cutting 2011).
D’altra banda, cal demanar un major rigor en la selecció i control dels Bacillus utilitzats, ja que alguns, si no han estat ben identificats, podrien ser causa de trastorns intestinals. En qualsevol cas, donat que el nombre de productes venuts com a probiòtics que contenen els esporulats Bacillus està augmentant molt, cal no donar per suposat que tots són segurs i cal avaluar cas per cas (Hong et al 2005).
Bibliografia
Barbosa TM, Serra CR, La Ragione RM, Woodward MJ, Henriques AO (2005) Screening for Bacillus isolates in the broiler gastrointestinal tract. Appl Environ Microbiol 71, 968-978.
Casula G, Cutting SM (2002) Bacillus probiotics: Spore germination in the gastrointestinal tract. Appl Environ Microbiol 68, 2344-2352.
Chukeatirote E (2015) Thua nao: Thai fermented soybean. J Ethnic Foods 2, 115-118.
Cutting SM (2011) Bacillus probiotics. Food Microbiol 28, 214-220.
Duc LH, Hong HA, Barbosa TM, Henriques AO, Cutting SM (2004) Characterization of Bacillus probiotics available for human use. Appl Environ Microbiol 70, 2161-2171.
FAO/WHO (2006) Probiotics in food. Health and nutritional properties and guidelines for evaluation. Fao Food and Nutrition Paper 85. Reports of Joint FAO/WHO expert consultations.
Fontana L, Bermudez-Brito M, Plaza-Diaz J, Muñoz-Quezada S, Gil A (2013) Sources, isolation, characterization and evaluation of probiotics. Brit J Nutrition 109, S35-S50.
Granum, P. E., T. Lund (1997) Bacillus cereus and its food poisoning toxins. FEMS Microbiol. Lett. 157:223–228.
Green, D. H., P. R. Wakeley, A. Page, A. Barnes, L. Baccigalupi, E. Ricca, S. M. Cutting (1999) Characterization of two Bacillus probiotics. Appl Environ Microbiol 65, 4288–4291.
Hoa, N. T., L. Baccigalupi, A. Huxham, A. Smertenko, P. H. Van, S. Ammendola, E. Ricca, A. S. Cutting (2000) Characterization of Bacillus species used for oral bacteriotherapy and bacterioprophylaxis of gastrointestinal disorders. Appl Environ Microbiol 66, 5241–5247.
Hong HA, Dic LH, Cutting SM (2005) The use of bacterial spore formers as probiotics. FEMS Microbiol Rev 29, 813-835.
Hong HA, Khaneja R, Tam NMK, Cazzato A, Tan S, Urdaci M, Brisson A, Gasbarrini A, Barnes I, Cutting SM (2009) Bacillus subtilis isolated from the human gastrointestinal tract. Res Microbiol 160, 134-143.
Lee S, Lee J, Jin YI, Jeong JC, Hyuk YH, Lee Y, Jeong Y, Kim M (2017) Probiotic characteristics of Bacillus strains isolated from Korean traditional soy sauce. LWT – Food Sci Technol 79, 518-524.
Mazza P (1994) The use of Bacillus subtilis as an antidiarrhoeal microorganism. Boll Chim. Farm. 133, 3-18.
Nimrat S, Suksawat S, Boonthai T, Vuthiphandchai V (2012) Potential Bacillus probiotics enhance bacterial numbers, water quality and growth during early development of white shrimp (Litopenaeus vannamei). Veterinary Microbiol 159, 443-450.
Phromraksa P, Nagano H, Kanamaru Y, Izumi H, Yamada C, Khamboonruang C (2009) Characterization of Bacillus subtilis isolated from asoian fermented foods. Food Sci Technol Res 15, 659-666.
Sanders ME, Morelli L, Tompkins TA (2003) Sporeformers as human probiotics: Bacillus, Sporolactobacillus, and Brevibacillus. Compr Rev Food Sci Food Safety 2, 101-110
Vaseeharan, B., P. Ramasamy (2003) Control of pathogenic Vibrio spp. by Bacillus subtilis BT23, a possible probiotic treatment for black tiger shrimp Penaeus monodon. Lett Appl Microbiol 36, 83–87
World Gastroenterology Organisation Global Guidelines (2011) Probiotics and Prebiotics.
Xiao et al. (2015) A catalog of the mouse gut metagenome. Nature Biotechnol 33, 1103-1108.




